题目内容
3. 已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略).下列说法正确的是( )
已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略).下列说法正确的是( )| A. | 若A为非金属单质,则它与Mg反应的产物,其阴阳离子个数比可能为2:3 | |
| B. | 若A为非金属单质,则其组成元素在周期表中的位置肯定处于第二周期第VA族 | |
| C. | 若D的浓溶液在常温下能使铁、铝发生钝化,则A一定为非金属单质 | |
| D. | 若A是共价化含物,0.l mol的A分子中含有的电子数可能为NA (NA为阿佛加德罗常数的值) |
分析 A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,且D为强电解质,中学常见物质中N、S元素单质化合物符合转化关系,Na元素单质化合物符合转化关系,据此解答.
解答 解:A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,且D为强电解质,中学常见物质中N、S元素单质化合物符合转化关系,Na元素单质化合物符合转化关系,
A.若A为非金属单质,能连续氧化且产物D为强电解质,则A为N或S,其中氮与镁反应的产物中阴阳离子的个数比为2:3,故A正确;
B.若A为非金属单质,A为氮气或硫,氮元素处于第二周期ⅤA族,硫元素处于第三周期ⅥA族,故B错误;
C.D的浓溶液能使铁、铝钝化,则D可能为浓硫酸或浓硝酸,A可能为H2S,故C错误;
D.若A是共价化合物,A可能为NH3或H2S,O.1mol的NH3分子中含有的电子数为NA,故D正确,
故选AD.
点评 本题考查无机物推断,涉及N、S、Na元素单质化合物性质与转化,需要学生熟练掌握元素化合物性质,注意掌握中学常见连续反应,难度较大.

练习册系列答案
相关题目
12.三氯化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气发生氧化还原反应,产物有HF、NO和HNO3,下列说法中,错误的是( )
| A. | 在潮湿天气,NF3泄漏常常容易察觉 | |
| B. | 一旦NF3泄露,可以用石灰水溶液喷淋的方法减少污染 | |
| C. | 上述反应中,被还原与被氧化的元素的物质的量之比为2:1 | |
| D. | 若生成22.4L(标准状况)NO气体,反应转移的电子数目为2mol |
13.下列根据实验操作和实验现象所得出的结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向2mL 2%CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后滴加M溶液,加热 | 未出现砖红色沉淀 | M中不含醛基 |
| B | 在CuSO4溶液中介入KI溶液,再加入苯,振荡后静置 | 有白色沉淀生成,苯层呈紫红色 | 白色沉淀可能为CuI |
| C | 向有机试剂N中加入2mL5%的NaOH溶液,加热,冷却后取上层溶液滴加几滴AgNO3溶液 | 出现褐色沉淀 | N不是卤代烃 |
| D | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液变为血红色 | Fe(NO3)2已氧化变质 |
11.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:2R(g)+5Q(g)?4X(g)+nY(g).反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
18.如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.该分子是( )
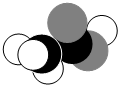

| A. | C2H5OH | B. | CH3COOH | C. | CH3CHO | D. | HCOOCH3 |
8.有短周期的aXn+、bYm- 两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | b-a=n+m | B. | a-b=n+m | C. | 核电荷数X>Y | D. | 质子数Y>X |
12.如图所示装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )


| A. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
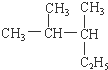 2,3-二甲基戊烷
2,3-二甲基戊烷
 )广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线:
)广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线: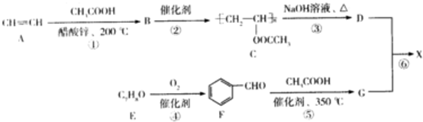

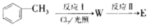
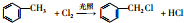 ,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
,反应Ⅱ的试剂为氢氧化钠水溶液、加热.