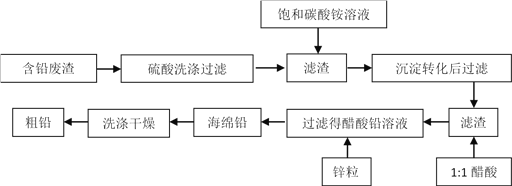
题目内容
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解等,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1,则该温度下水的离子积常数KW=_______;该温度下,pH=10的Ba(OH)2溶液的物质的量浓度为_________。
(2)25℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度由大到小顺序为______(用序号回答)。
(3)25℃时,将 a mol·L-1 的醋酸和 b mol·L-1 的氢氧化钠溶液等体积混合后,溶液的pH=7,则溶液中c(CH3COO-)+c(CH3COOH)=__________,则a_______ b(填“﹥”、“﹤”或“=”)。
(4)将AgCl分别放入:①5 mL水 ②10 mL 0.1 mol·L-1 MgCl2溶液 ③20 mL 0.5 mol·L-1 NaCl溶液 ④40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、 c、d,它们由大到小的排列顺序是_____(用字母表示)。
【答案】 1×10-12 mol2·L-2 0.005 mol·L-1 ④①②③ 0.5a mol·L-1 ﹥ a﹥b﹥d﹥c
【解析】(1)本题考查水的离子积的应用,纯水中存在H2O![]() H++OH-,Kw=c(H+)×c(OH-)=1×10-6×1×10-6=1×10-12,该温度下pH=10的Ba(OH)2溶液中c(OH-)=Kw/c(H+)=10-12/10-10mol·L-1=10-2mol/l,因此Ba(OH)2的浓度为10-2/2mol·L-1=5×10-3mol·L-1;(2)本题考查影响水电离的因素,①NaCl对水的电离无影响,④(NH4)2SO4为强酸弱碱盐,NH4+发生水解,促进水的电离,NaOH和H2SO4抑制水的电离,因为NaOH和H2SO4浓度相同,因此NaOH溶液中c(OH-)低于H2SO4溶液中c(H+),因此硫酸抑制水电离程度大,综上所述,水的电离程度大小顺序是④①②③;(3)本题考查物料守恒,等体积混合,c(CH3COOH)=a/2mol·L-1,根据物料守恒,c(CH3COO-)+c(CH3COOH)=0.5amol·L-1,醋酸是弱酸,且混合后pH=7,醋酸应稍微过量,即a>b;(4)考查溶度积,AgCl(s)
H++OH-,Kw=c(H+)×c(OH-)=1×10-6×1×10-6=1×10-12,该温度下pH=10的Ba(OH)2溶液中c(OH-)=Kw/c(H+)=10-12/10-10mol·L-1=10-2mol/l,因此Ba(OH)2的浓度为10-2/2mol·L-1=5×10-3mol·L-1;(2)本题考查影响水电离的因素,①NaCl对水的电离无影响,④(NH4)2SO4为强酸弱碱盐,NH4+发生水解,促进水的电离,NaOH和H2SO4抑制水的电离,因为NaOH和H2SO4浓度相同,因此NaOH溶液中c(OH-)低于H2SO4溶液中c(H+),因此硫酸抑制水电离程度大,综上所述,水的电离程度大小顺序是④①②③;(3)本题考查物料守恒,等体积混合,c(CH3COOH)=a/2mol·L-1,根据物料守恒,c(CH3COO-)+c(CH3COOH)=0.5amol·L-1,醋酸是弱酸,且混合后pH=7,醋酸应稍微过量,即a>b;(4)考查溶度积,AgCl(s)![]() Ag+(aq)+Cl-(aq),①水溶液中c(Ag+)=
Ag+(aq)+Cl-(aq),①水溶液中c(Ag+)=![]() ,②c(Ag+)=Ksp/c(Cl-)=Ksp/0.1mol·L-1,③c(Ag+)=Ksp/c(Cl-)=Ksp/0.5mol·L-1,④c(Ag+)=Ksp/c(Cl-)=Ksp/0.3mol·L-1,因此c(Ag+)大小顺序是a>b>d>c。
,②c(Ag+)=Ksp/c(Cl-)=Ksp/0.1mol·L-1,③c(Ag+)=Ksp/c(Cl-)=Ksp/0.5mol·L-1,④c(Ag+)=Ksp/c(Cl-)=Ksp/0.3mol·L-1,因此c(Ag+)大小顺序是a>b>d>c。

【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D