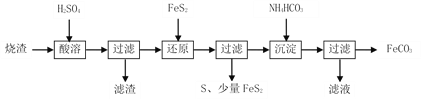
题目内容
【题目】冶金工业中,从冶铅废渣中再提取铅的工艺流程如下:
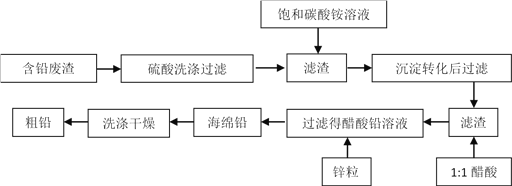
已知:Ksp (PbSO4) =1.6×10 -8;Ksp (PbCO3) =8.0×10 -14;醋酸铅易溶于水,难电离。
回答下列问题:
(1)此化工工艺达到了以下哪些目的:______________
A.减少环境污染 B.提高资源利用率 C.制备醋酸铅 D.制备了纯铅
(2)硫酸洗涤后,生成的PbSO4表面常含有铜单质,为溶解铜,常需要同时加入一定量的H2O2溶液,写出溶解铜的离子方程式:_________________________________;为加快此反应的速率,下列方法合适的是:_____________。
A.搅拌 B.适当加热 C.减压 D.将PbSO4固体粉碎
(3)加入碳酸铵溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),通过计算,说明该反应能进行的原因:_________________________。这一步骤中,也可以将碳酸铵改用碳酸氢铵,但实际生产效果不好,请说明其中的一个原因:______________________________________________________。
(4)处理含铅废渣1000g(含铅以PbSO4计,质量分数为0.303),若回收率为 95% 。经原子吸收分光光度法及 EDTA 滴定法测定,产品(粗铅)纯度为 90%。则得到的粗铅质量为(保留一位小数)______________。
【答案】 AB Cu+H2O2+2H+=Cu2++2H2O ABD 该反应平衡常数K=2.0×105,所以能进行 改用碳酸氢铵会减小CO32-的浓度,不利于生成PbCO3。随着反应进行,酸性逐渐增强,部分HCO3-会生成CO2被消耗。 218.5g
【解析】试题(1)含铅废渣对环境造成污染;从含铅废渣中提取铅可以提高资源利用率;该流程中醋酸铅不是最终产品;该流程最终产品粗铅;(2)酸性条件下铜被H2O2氧化为Cu2+;根据影响反应速率的因素分析加快此反应的速率的方法;(3)平衡常数越大,反应进行的程度越大;改用碳酸氢铵会减小CO32-的浓度,不利于生成PbCO3。(4)根据铅元素守恒计算粗铅的质量。
解析:(1)含铅废渣对环境造成污染;从含铅废渣中提取铅可以提高资源利用率;该流程中醋酸铅不是最终产品;该流程最终产品粗铅,故AB正确;(2)酸性条件下铜被H2O2氧化为Cu2+,反应的离子方程式是Cu+H2O2+2H+=Cu2++2H2O;搅拌能加快反应速率;升高温度反应速率加快;该反应没有气体参与,减压对反应速率无影响;将PbSO4固体粉碎,可以增大接触面积,加快反应速率,故选ABD;(3)PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),平衡常数K=![]() 2.0×105,所以能进行;改用碳酸氢铵会减小CO32-的浓度,不利于生成PbCO3,随着反应进行,酸性逐渐增强,部分HCO3-会生成CO2被消耗。(4)设粗铅的质量是xg
2.0×105,所以能进行;改用碳酸氢铵会减小CO32-的浓度,不利于生成PbCO3,随着反应进行,酸性逐渐增强,部分HCO3-会生成CO2被消耗。(4)设粗铅的质量是xg
1000g![]()
X=218.5g