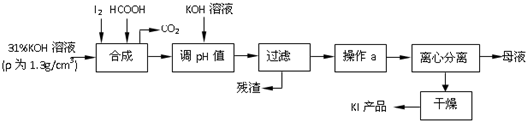
��Ŀ����
12��ͭ����������;�㷺�Ľ�������ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ����ս���ͭ����������ͼ1��CaSO4���ܽ��������ͼ2�� ��֪���������ʳ�����pH�����
��֪���������ʳ�����pH�����| Fe3+ | Cu2+ | Cr3+ | |
| ��ʼ����pH | 2.1 | 4.7 | 4.3 |
| ��ȫ����pH | 3.2 | 6.7 | a |
��1����ҺI������������Ҫ��Fe2��SO4��3��Cr2��SO4��3��CuSO4���ѧʽ����
��2���ڢڲ������У��ȼ���Ca��OH��2������Һ��pH�����ڷ�ΧΪ3.2��pH��4.3��Ȼ����Һ������80����ȹ��ˣ�����������ijɷ�ΪFe��OH��3��CaSO4��
��3���ڢ۲������У����ֳ�������ש��ɫ�����⣬����������ɫ�̼�����ζ�����壮д���ò����з�����Ӧ�����ӷ���ʽ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O��
��4��������Ũ�ȡ�1��10-5mol•L-1ʱ��������Ϊ���ӳ�����ȫ���ڢܲ������У���ҪʹCr3+��ȫ����������������Һ��a����Сֵ������Ϊ5.6����ó���ֵʱ�������ṩ�������ǣ��ܶȻ�������
��5��Cr��OH��3���ȷֽ�ΪCr2O3�������ȷ�����ұ����������д�����ȷ������Ļ�ѧ����ʽ��Cr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr��
���� �������м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2��SO4��3+3H2O��CuO+H2SO4=CuSO4+H2O��Cr2O3+3H2SO4=Cr2��SO4��3+3H2O��Ȼ����˵õ�����I����ҺI����ҺI������ΪFe2��SO4��3��Cr2��SO4��3��CuSO4������Һ�м���Ca��OH��2����������ҺpH����������ͼ����ҺII�к���Cr3+��Cu2+������ Fe3+��˵������II�к���Fe��OH��3�����������������Գ���II�ɷ�ΪFe��OH��3��CaSO4��ҪʹCr3+��Cu2+��������Fe3+���������������������ɳ�����ҪpHֵ֪����Һ��pH��ΧΪ3.2-4.3֮�䣻����Һ�м���NaHSO3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O�����˵õ�Cu2O������Һ�м���NaOH��������ҺpH��������ӦCr3++3OH-=Cr��OH��3������ҺIV�к���NaOH��Na2SO4���Դ������
��� �⣺�������м���ϡ���ᣬ������ӦFe2O3+3H2SO4=Fe2��SO4��3+3H2O��CuO+H2SO4=CuSO4+H2O��Cr2O3+3H2SO4=Cr2��SO4��3+3H2O��Ȼ����˵õ�����I����ҺI����ҺI������ΪFe2��SO4��3��Cr2��SO4��3��CuSO4������Һ�м���Ca��OH��2����������ҺpH����������ͼ����ҺII�к���Cr3+��Cu2+������ Fe3+��˵������II�к���Fe��OH��3�����������������Գ���II�ɷ�ΪFe��OH��3��CaSO4��ҪʹCr3+��Cu2+��������Fe3+���������������������ɳ�����ҪpHֵ֪����Һ��pH��ΧΪ3.2-4.3֮�䣻����Һ�м���NaHSO3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ����������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O�����˵õ�Cu2O������Һ�м���NaOH��������ҺpH��������ӦCr3++3OH-=Cr��OH��3������ҺIV�к���NaOH��Na2SO4��
��1��������������֪����ҺI������������Ҫ��Fe2��SO4��3��Cr2��SO4��3��CuSO4���ʴ�Ϊ��Fe2��SO4��3��Cr2��SO4��3��CuSO4��
��2���ڢڲ������У��ȼ���Ca��OH��2������Һ��pH����ȥFe3+���ɱ�����pH��֪�����ڷ�ΧΪ3.2��pH��4.3��������ת��Ϊ��������������ܣ�Ȼ����Һ������80����ȹ��ˣ�����������ijɷ�ΪFe��OH��3��CaSO4���ʴ�Ϊ��3.2��pH��4.3��Fe��OH��3��CaSO4��
��3�����������ƾ��л�ԭ�ԡ�ͭ���Ӿ��������ԣ����߷���������ԭ��Ӧ���������ש��ɫ����Cu2O�������������������ӷ�Ӧ���ɶ���������۲��������ӷ���ʽΪ2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O��
�ʴ�Ϊ��2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+��HSO3-+H+=SO2��+H2O��
2H2O+HSO3-+2Cu2+=Cu2O��+SO42-+5H+ ��2�֣� HSO3-+H+=SO2��+H2O��2�֣�
��4��������Ũ�ȡ�1��10-5mol•L-1ʱ��������Ϊ���ӳ�����ȫ����ҪʹCr3+��ȫ��������c��Cr3+����1��10-5mol•L-1��pH=-lg2.5��10-6=5.6��c��H+��=2.5��10-6mol/L��c��OH-��=$\frac{1{0}^{-14}}{2.5��1{0}^{-6}}$=4.0��10-9 mol/L����c��OH-��=$\root{3}{\frac{Ksp}{c��C{r}^{3+}��}}$mol/L=4.0��10-9 mol/L������ó���ֵʱ�������ṩ������Ϊ�ܶȻ�������
�ʴ�Ϊ���ܶȻ�������
��5�����ȷ������Ļ�ѧ����ʽΪCr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr���ʴ�Ϊ��Cr2O3+2Al$\frac{\underline{\;����\;}}{\;}$Al2O3+2Cr��
���� ���⿼�����ʵķ�����ᴿ�ۺ�Ӧ�ã�Ϊ�߿���Ƶ�㣬�漰��������ܽ�ƽ�⡢����ұ��������ʵ�������֪ʶ�㣬���ط��������㼰ʵ���������D�Ŀ��飬ע������ͼ���漰�ķ�Ӧ�������������ѵ����ܶȻ��������㣬��Ŀ�Ѷ��еȣ�

 ��ѧ����ϵ�д�
��ѧ����ϵ�д�| A�� | ����Ƭ��ϡ���ᷴӦ������ʱ�����뼸������ͭ��Һ���Լӿ췴Ӧ���� | |
| B�� | ����β���е�NO��CO���Ի�����Ӧ����N2��CO2����Сѹǿ��Ӧ���ʱ��� | |
| C�� | SO2�Ĵ�������Ӧ��һ�����ȵķ�Ӧ�����������¶ȣ���Ӧ���ʱ��� | |
| D�� | 100 mL 2 mol•L-1�������пƬ��Ӧ�������������Ȼ�����Һ����Ӧ���ʲ��� |
��pH=2�Ĵ�����Һϡ�������Ϊԭ����100����pH��4
��ϡ�Ĵ�����Һ�м��������Ĵ���粒��壬��Һ�����Լ��������������ˮ�����ԣ�
�ۿ�����ʳ�������ˮƿ�ڵ�ˮ����
| A�� | �٢� | B�� | �٢� | C�� | �ڢ� | D�� | ȫ�� |
| A�� | O2 | B�� | Fe | C�� | H2 | D�� | Hg |
| A�� | ������ͨ��FeCl2��Һ�� | |
| B�� | ���̶���ļ�Ͷ��ˮ�� | |
| C�� | ��һ�δ�ĥ����þ������������ˮ�� | |
| D�� | ����ˮ�μӵ�KI������Һ�� |
| A�� | ��ij�¶��£���Ӧ��$\frac{c��C{l}^{-}��}{c��Cl{O}^{-}��}$=11������Һ��$\frac{c��Cl{O}^{-}��}{c��Cl{O}_{3}^{-}��}$=$\frac{1}{5}$ | |
| B�� | �μӷ�Ӧ�ı���ԭ������Ϊ$\frac{1}{4}$amol | |
| C�� | �ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��$\frac{1}{2}$amol��ne��$\frac{5}{6}$amol | |
| D�� | �ı��¶ȣ�������KClO3��������۲���Ϊ$\frac{5}{6}$amol |
| A�� | �ԣ�A��=0.2mol/��L•s�� | B�� | �ԣ�B��=0.3 mol/��L•s�� | C�� | �ԣ�C��=0.8 mol/��L•s�� | D�� | �ԣ�D��=1 mol/��L•s�� |
| A�� | �������Ӳ�����4������ | B�� | �������Ϊ+2 | ||
| C�� | �������Ϊ+4 | D�� | �ڶ����Ӳ�û��δ�ɶԵ��� |