题目内容
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
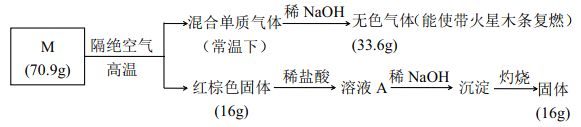
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。

【答案】-11.5 BD 25% X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动 Pb3O4+8HI=3PbI2+I2+4H2O 12 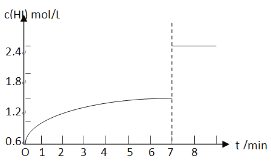
【解析】
(1)反应热=反应物总键能—生成物总键能,故△H=[3E(C—H)+E(C—O)+E(H—O)+3E(N—H)]-[3 E(C—H)+E(C—N)+2E(N—H)+2E(H—O)]=(351.5+393-293-463)kJ/mol=-11.5kJ/mol;
(2)①A.由于体系的体积不变,气体的质量不变,所以任何情况下气体的密度保持不变,故不能作为判断平衡的标志,A错误;
B.CO是反应物,CH3OH是生成物,二者的系数相等,CO的消耗速率与等于CH3OH的消耗速率相等,则反应处于平衡状态,B正确;
C.CO、H2都是反应物,二者反应的物质的量的比是1:2,加入的二者的物质的量的比是1:2,所以任何情况下体系中CO的转化率和H2的转化率相等,不能判断反应是否为平衡状态,C错误;
D.若反应未达到平衡状态,则CH3OH的体积分数就会发生变化,现在体系中CH3OH的体积分数保持不变,则反应处于平衡状态,D正确;
故合理选项是BD;
②对于反应CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。正反应是气体体积减小的反应,
CH3OH(g) ΔH<0。正反应是气体体积减小的反应,
初始量: 1mol 2mol 0
变化量: x 2x x
平衡量: 1-x 2-2x x
平衡时,CH3OH的体积分数为10%,则![]() ,解得x=0.25,所以CO的转化率为
,解得x=0.25,所以CO的转化率为![]() 。
。
③根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,平衡逆向移动,故Y表示温度;
(3)由四氧化三铅和氢碘酸反应制备难溶的PbI2,反应的化学方程式为:Pb3O4+8HI=3PbI2+I2+4H2O;
(4)①由表中数据可知,5min时处于平衡状态,设I2消耗浓度为xmol/L,则:
I2(g) + H2(g)![]() 2HI(g)
2HI(g)
起始浓度(mol/L):0.8 1.2 0
转化浓度(mol/L):x x 2x
平衡浓度(mol/L) 0.8-x 1.2-x 2x
HI的体积分数为60%,则:![]() =60%,解得x=0.6,化学平衡常数K=
=60%,解得x=0.6,化学平衡常数K=![]() 。
。
②达到平衡后,HI的浓度为1.2mol/L,在7min时将容器体积压缩为原来的一半,由于该反应是气体体积不变的反应,所以压强增大,化学平衡不发生移动,HI的浓度变为原平衡的2倍,即HI浓度变为2.4mol/L,c(HI)随时间变化的曲线为:
 。
。