题目内容
【题目】为有效提升空气质量,国家强制各燃煤企业要对燃媒烟气进行脱硫、脱硝处理后排放。回答下列问题:
(1)燃煤烟气“脱硝”中涉及到的部分反应如下:
a.4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H1
5N2(g)+6H2O(g)△H1
b.4NH3(B)+5O2(g)![]() 4NO(g)+6H2O(g)△H2=-925kJ·mol-1
4NO(g)+6H2O(g)△H2=-925kJ·mol-1
c.N2(g)+O2(g)![]() 2NO(g)△H3=+175kJ·mol-1
2NO(g)△H3=+175kJ·mol-1
则△H1=_________kJ·mol-1。
(2)向某恒容密闭容器中加入2molNH3、3molINO,在适当条件下发生(1)中反应a,反应过程中NO的平衡转化率随温度T、压强p的变化曲线如图1所示:

①p1_________p2(填“>”“<”或“=”)。
②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,则NO的转化率为_________。
③600℃时,下列各项数据中能表明该反应已达到化学平衡状态的是_________(填标号)。
a.水与NO的生成速率相等 b.混合气体的密度保持不变
c.NH3、N2生成速率比为5∶4 d.容器的总压强保持不变
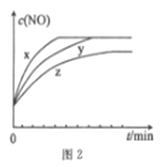
(3)将2molN2、3molH2O(g)、0.5molNO的混合气体置于x、y、z三个容积相同的恒容密闭容器中,控制适当的条件发生反应,反应过程中c(NO)随时间的变化如图2所示。
①在建立平衡的过程中,三个容器中反应速率的相对大小为______________。
②与y容器中反应相比,z容器中反应改变的条件及判断依据分别是____________________________。
(4)2000℃下,在一个2L的密闭容器里发生(1)中反应c,起始时氮气和氧气的浓度均为0.69 mol·L-1,达到平衡时NO的浓度为0.18 mol·L-1,期2000℃时该反应的平衡常数K=__________。
(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,则该盐的化学式为_________。
【答案】 -1800 > 33.3% ad x>y>z 降低温度,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低 0.09 NaNO2
【解析】(1)已知b.4NH3(B)+5O2(g)![]() 4NO(g)+6H2O(g)△H2=-925kJ·mol-1
4NO(g)+6H2O(g)△H2=-925kJ·mol-1
c.N2(g)+O2(g)![]() 2NO(g)△H3=+175kJ·mol-1
2NO(g)△H3=+175kJ·mol-1
根据盖斯定律,由b-5 c得反应a.4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) 则△H1=△H2-5△H3=-925kJ·mol-1-5
5N2(g)+6H2O(g) 则△H1=△H2-5△H3=-925kJ·mol-1-5![]() 175kJ·mol-1=-1800kJ·mol-1;(2) ①反应4NH3(g)+6NO(g)
175kJ·mol-1=-1800kJ·mol-1;(2) ①反应4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)是气体体积增大的反应,增大压强,平衡逆向移动,当温度相同时,p2条件下NO的平衡转化率大于p1条件下NO的平衡转化率,故p1> p2;②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,根据反应4NH3(g)+6NO(g)
5N2(g)+6H2O(g)是气体体积增大的反应,增大压强,平衡逆向移动,当温度相同时,p2条件下NO的平衡转化率大于p1条件下NO的平衡转化率,故p1> p2;②若在压强为p2、温度为600℃时,达到平衡时反应体系内化学能降低了300kJ,根据反应4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H1=1=-1800kJ·mol-1可知,反应消耗1 molNO,则NO的转化率为
5N2(g)+6H2O(g) △H1=1=-1800kJ·mol-1可知,反应消耗1 molNO,则NO的转化率为![]() ;③a.水与NO的化学计量数相等,两者的生成速率分别表示正逆反应速率,当两者生成速率相等时,反应达平衡状态,选项a正确;b.反应在恒容容器中进行,参与的反应物均为气体,混合气体的密度始终保持不变,平衡不一定达平衡,选项b错误;c.NH3、N2生成速率比为5∶4 与反应计量数不相等,正逆反应速率不相等,没有达到平衡状态,选项c错误;d.反应为气体体积增大的反应,容器的总压强保持不变说明已达平衡状态,选项d正确。答案选ad;(3)①根据“先拐先平”原则,在建立平衡的过程中,三个容器中反应速率的相对大小为x>y>z;②该反应正反应为放热反应,降低温度平衡正向移动,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低,故与y容器中反应相比,z容器中反应改变的条件及判断依据分别是降低温度;
;③a.水与NO的化学计量数相等,两者的生成速率分别表示正逆反应速率,当两者生成速率相等时,反应达平衡状态,选项a正确;b.反应在恒容容器中进行,参与的反应物均为气体,混合气体的密度始终保持不变,平衡不一定达平衡,选项b错误;c.NH3、N2生成速率比为5∶4 与反应计量数不相等,正逆反应速率不相等,没有达到平衡状态,选项c错误;d.反应为气体体积增大的反应,容器的总压强保持不变说明已达平衡状态,选项d正确。答案选ad;(3)①根据“先拐先平”原则,在建立平衡的过程中,三个容器中反应速率的相对大小为x>y>z;②该反应正反应为放热反应,降低温度平衡正向移动,z容器达到平衡所用时间比y容器中长,平衡时c(NO)也比y容器中的低,故与y容器中反应相比,z容器中反应改变的条件及判断依据分别是降低温度;
(4) N2(g)+O2(g)![]() 2NO(g)
2NO(g)
开始时的浓度(mol/L) 0.69 0.69 0
改变的浓度(mol/L) 0.09 0.09 0.18
平衡时的浓度(mol/L) 0.60 0.60 0.18
平衡常数K=![]() ;(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,发生反应为2NaOH+NO+NO2= 2NaNO2+H2O,则该盐的化学式为NaNO2。
;(5)将NO、NO2用NaOH溶液吸收也可消除氮氧化物污染,适当比例的NO、NO2通入NaOH溶液中可得到一种盐X,发生反应为2NaOH+NO+NO2= 2NaNO2+H2O,则该盐的化学式为NaNO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将甲、乙两种有机物在常温常压下的混合物分离。已知它们的物理性质如下:
物质 | 密度/(g/cm3) | 沸点/℃ | 水溶性 | 溶解性 |
甲 | 0.7893 | 68.5 | 溶 | 溶于乙 |
乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
则应采用的分离方法是( )
A. 分液 B. 蒸馏 C. 过滤 D. 萃取