题目内容
【题目】[化学——选修3:物质结构与性质]
铜、银、金与社会生活联系密切。
(1)在周期表中, 铜、银、金位于同一族,它们基态原子的外围电子排布式的通式为__________________(用n表示电子层数),它们位于元素周期表的________区。
(2)化学上,银氨溶液可以检验醛基的存在,例如:H3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3
CH3COONH4+2Ag↓+3NH3
+H2O。1个CH3CHO分子中所含π键的数目为________,碳原子的杂化轨道类型为________;CH3 CH2OH、CH3CHO的相对分子质量仅相差2,但沸点相差很大(分别为78.5℃,20.8℃),其主要原因是________________________;NH3的VSEPR模型为________。
(3)金不溶于硝酸,但溶于“王水”,发生反应:Au+4HCl+HNO3=H[AuCl4]+NO↑+2H2O。金溶于王水的主要原因是形成了[AuCl4],提高了金的活动性。在[AuCl4]-中,金离子的配位数为________,画出该配离子的结构式:________。
(4)金、银、铜都有良好的延展性,解释其原因:________________________________。
(5)金、银的一种合金具有较强的储氢能力。该合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点。若该晶胞边长为anm,金、银原子的半径分别为bnm、cnm。则该晶胞的空间利用率(φ)
为________ (用含a、b、c和圆周率π的式子表示)。
【答案】 (n-1)d10ns1 ds 1 sp3、sp2 CH3CH2OH分子间存在氢键,CH3CHO分子间无氢键 四面体形 4 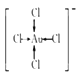 金、银、铜受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,金属键仍然存在
金、银、铜受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,金属键仍然存在 ![]() ×100%
×100%
【解析】(1)在元素周期表中,Cu、Ag、Au位于ⅠB族、各能级电子数相等价电子通式为(n-1)d10ns1;它们位于元素周期表的ds区;(2)①CH3CHO中有一个碳氧双键,双键中有一个π键,所以1个CH3CHO分子中π键的数目为1,根据碳原子周围的成键情况和孤电子对数可知,甲基中的碳的杂化方式为sp3,醛基中的碳原子的杂化方式为sp2;CH3CH2OH分子间存在氢键,CH3CHO分子间无氢键,故CH3 CH2OH、CH3CHO的相对分子质量仅相差2,但沸点相差很大;NH3分子中N原子价层电子对个数=σ键个数+孤电子对个数=3+![]() (5-3×1)=4,VSEPR模型为正四面体结构;(3)在[AuCl4]-中,与金离子最近的的氯离子有4个,故配位数为4,该配离子的结构式为:
(5-3×1)=4,VSEPR模型为正四面体结构;(3)在[AuCl4]-中,与金离子最近的的氯离子有4个,故配位数为4,该配离子的结构式为: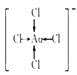 ;(4) 金、银、铜受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,金属键仍然存在,故金、银、铜都有良好的延展性;(5)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×
;(4) 金、银、铜受到外力作用时,晶体中的各原子层就会发生相对滑动,但不会改变原来的排列方式,金属键仍然存在,故金、银、铜都有良好的延展性;(5)合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点,所以晶胞中银原子数为6×![]() =3,金原子数为8×
=3,金原子数为8×![]() =1,金、银原子的半径分别为bnm、cnm,则晶胞中金、银原子的体积为
=1,金、银原子的半径分别为bnm、cnm,则晶胞中金、银原子的体积为![]() ,晶胞的体积为
,晶胞的体积为![]() ;所以该晶胞的空间利用率为:
;所以该晶胞的空间利用率为: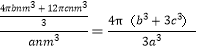 。
。

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】下列古诗中对应的化学物质及相关说法均正确的是
选项 | 诗句 | 相关物质 | 相关说法 |
A | 春蚕到死丝方尽 | 纤维素 | 高分子化合物 |
B | 蜡炬成灰泪始干 | 脂肪烃 | 饱和烃 |
C | 沧海月明珠有泪 | 碳酸钙 | 弱电解质 |
D | 蓝田日暖玉生烟 | 二氧化硅 | 两性氧化物 |
A. A B. B C. C D. D
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20[] | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15[] |
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1<T2
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②