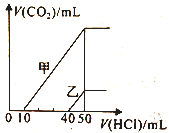
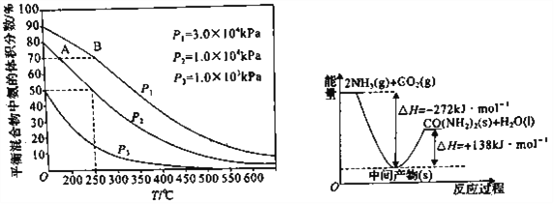
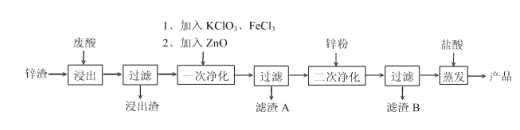
题目内容
【题目】某课外实验小组设计的下列实验不合理的是 ( )



A. 图1:制备并观察氢氧化亚铁 B. 图2:证明过氧化钠与水反应放热
C. 图3:萃取分液时放出碘的苯溶液 D. 图4:比较NaHCO3和Na2CO3热稳定性
【答案】CD
【解析】试题分析:A. 先打开止水夹,铁与稀硫酸反应生成的氢气将装置内的空气排尽,然后关闭止水夹,氢气将生成的硫酸亚铁溶液压入氢氧化钠溶液中可生成白色沉淀氢氧化亚铁,合理,错误;B. 将2滴水滴加到包有过氧化钠的脱脂棉上,脱脂棉燃烧,证明过氧化钠与水反应放出热量,合理,错误;C. 分液时,下层液体从下口放出,上层液体从上口倒出,苯的密度比水小,应从分液漏斗的上口倒出碘的苯溶液,不合理,正确; D.碳酸氢钠在外试管,受热温度比碳酸钠高,不能通过该装置比较NaHCO3和Na2CO3热稳定性,不合理,正确。选CD。

 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?_____(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,反应的离子方程式为_____________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:___________;
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________;
(3)熔融物中铝元素的物质的量为_______mol。
(4)B点对应的沉淀的物质的量为____mol。