题目内容
【题目】对于可逆反应 SiO2(s)+C(s)+N2(g)![]() Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
Si3N4(s)+CO(g)(未配平)△H <0,下列叙述正确的是
A. 该反应的氧化剂为N2,还原产物为CO
B. 增加焦炭的用量,生成氮化硅的反应速率增大
C. 反应中每生成0.1 mol Si3N4转移的电子为1.2 mol
D. 反应的平衡常数可表示为K=c(CO)/c(N2),升高温度K减小
【答案】C
【解析】由产物CO可知,SiO2与C化学计量数之比为1:2 由产物Si3N4可知SiO2与N2化学计量数之比为3:4,所以SiO2、C+、N2化学计量数之比为3:6:4,令SiO2的化学计量数为3,结合元素守恒可知Si3N4、CO化学计量数分别为1、6,配平后方程式为3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)△H<0。A、在氮化硅的合成反应中,氮元素的化合价由0价降低到-3价,所以氮气是氧化剂;碳元素的化合价升高,被氧化成CO,CO是氧化产物,故A错误;B、增加焦炭的用量,气体的浓度不变,反应速率不变,故B错误;C、氮元素的化合价总共降低了4×(3-0)=12价,所以每生成1molSi3N4,N2得到12mol电子,当生成0.1molSi3N4时转移电子的物质的量为1.2mol,故C正确;D、此反应的平衡常数K=
Si3N4(s)+6CO(g)△H<0。A、在氮化硅的合成反应中,氮元素的化合价由0价降低到-3价,所以氮气是氧化剂;碳元素的化合价升高,被氧化成CO,CO是氧化产物,故A错误;B、增加焦炭的用量,气体的浓度不变,反应速率不变,故B错误;C、氮元素的化合价总共降低了4×(3-0)=12价,所以每生成1molSi3N4,N2得到12mol电子,当生成0.1molSi3N4时转移电子的物质的量为1.2mol,故C正确;D、此反应的平衡常数K=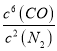 ,对于放热反应,升高温度,平衡常数减小,故D错误;故选C。
,对于放热反应,升高温度,平衡常数减小,故D错误;故选C。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。[已知N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4 kJ·mol-1]
2NH3(g)ΔH=-92.4 kJ·mol-1]
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是( )
A. 2c1>c3 B. α1+α3=1 C. 2 p2 <p3 D. a+b=92.4
