题目内容
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
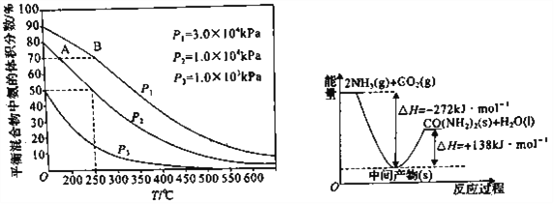
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。
(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
【答案】 减小 增大 69.1 < c(H+)>c(SO42-)>c(NH4+)>c(OH-) CO2(g)+2NH3(g)=CO(NH2)2(s)+H2O(1) △H=-134kJmol-1
【解析】(1)在恒温恒容条件下,向反应平衡体系中充入氮气,氮气的浓度增大,平衡正向移动,达到新平衡时,c(H2)将减小,c(NH3)增大,温度不变,平衡常数不变,根据K=![]() ,可知 c(N2)·c3(H2)增大,故答案为:减小;增大;
,可知 c(N2)·c3(H2)增大,故答案为:减小;增大;
(2)200℃,CH4(g)的转化率80%,所以参加反应的CH4(g)的物质的量为0.8mol,
对于反应 CH4(g)+H2O(g)![]() CO(g)+3H2(g);
CO(g)+3H2(g);
开始(mol/L): 0.5 0.5 0 0
变化(mol/L): 0.4 0.4 0.4 1.2
平衡(mol/L): 0.1 0.1 0.4 1.2
所以200℃时该反应的平衡常数K=![]() =
=![]() =69.1,故答案为:69.1;
=69.1,故答案为:69.1;
(3)温度越大,压强越大,反应速率越大,由图可知,B对应的温度、压强大,则反应速率大,故答案为:<;
(4)NH4HSO4完全电离,溶液呈酸性,则c(H+)>c(OH-)且溶液中铵根离子水解,则c(H+)>c(SO42-),故溶液中离子浓度大小顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-),故答案为:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(5)由图示可知,第一步:2NH3(g)+CO2(g)中间产物 △H1=-272KJ/mol,第二步:中间产物H2O(l)+H2NCONH2(s)△H2=+138KJ/mol,根据盖斯定律,两个过程相加得到NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)H2O(l)+H2NCONH2(s)△H=-134kJmol-1, 故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol。

 阅读快车系列答案
阅读快车系列答案