ћвƒњƒЏ»Ё
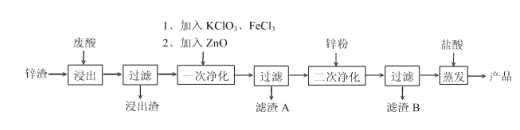
°Њћвƒњ°њ“‘ƒ≥“±Ѕґ≥І≈≈Ј≈µƒЈѕЋб(÷ч“™≥…Ј÷ќ™—ќЋб,ЇђFe2+. Pb2+. Cu2+. H3AsO3µ»‘”÷ )ЇЌ–њ‘ь(ЇђZnO°ҐZnЉ∞∆дЋыЋб≤ї»№ќп)ќ™‘≠Ѕѕ÷∆±Єµз≥ЎЉґZnCl2»№“Їµƒє§“’Ѕч≥ћ»зѕ¬:
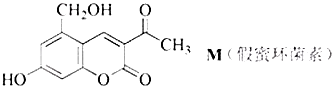
“—÷™£ЇFe3+њ™ Љ≥Ѕµн ±pHќ™2.7£ђFeAsO4ƒ—»№”ЏЋЃ°£
їЎірѕ¬Ѕ–ќ ћв
£®1£©H3AsO3(—«…йЋб)÷–As‘™ЋЎµƒїѓЇѕЉџ «________°£
£®2£©°∞љю≥ц°± ±Јі”¶≥Ў”¶‘ґјлїр‘і°£‘≠“т «________°£
£®3£©°∞“їіќЊїїѓ°±њ…“‘≥э»•Fe°ҐAs‘™ЋЎ,Љ”»лKClO3°ҐFeCl3≥э»•ћъ ±ЈҐ…ъЈі”¶µƒјл„”Јљ≥ћ љќ™________________________£ђЉ”»лZnOµƒƒњµƒ «________________________£ђ∆д”аЈі”¶ќ™KClO3+3H3AsO3 ![]() KCl+3H3AsO4 ЇЌFeCl3+H3AsO4
KCl+3H3AsO4 ЇЌFeCl3+H3AsO4![]() FeAs04+3HCl,‘т¬Ћ‘ьAµƒ≥…Ј÷ «________£ђ________°£
FeAs04+3HCl,‘т¬Ћ‘ьAµƒ≥…Ј÷ «________£ђ________°£
£®4£©°∞≤ъ∆Ј°±÷–µƒ÷ч“™‘”÷ «________,±№√в≤ъ…ъЄ√‘”÷ µƒЄƒљшЈљ∞Є «_______________________°£
£®5£©–њЊџ±љ∞Јµз≥ЎЊя”–ЉџЄс±г“Ћ°Ґ÷ЎЅњ«бµ»”≈µг,‘Џµзґѓ∆ы≥µ––“µ”¶”√«∞Њ∞єгјЂ°£ЄЇЉЂ є”√µƒ «Єяіњґ»–њ∆ђ,“‘ZnCl2ЇЌNH4Clќ™÷ч“™µзљв÷ °£–њЊџ±љ∞Јµз≥ЎЈ≈µз ±,ЄЇЉЂ≤ƒЅѕ…ѕµƒµзЉЂЈі”¶ љќ™________________________°£
°Њір∞Є°њ +3 Јі”¶≥Ў÷––њ”л—ќЋбЈі”¶”–H2…ъ≥… KClO3+6FeCl2+6HCl ![]() 6FeCl3+KCl+3H2O µчљЏ»№“ЇµƒpH“‘іўљшFe3+ЈҐ…ъЋЃљв…ъ≥…«в—хїѓћъ≥Ѕµн FeAsO4 Fe(OH)3 KCl ”√H2O2(їтCl2)іъћжKClO3 Zn-2e-
6FeCl3+KCl+3H2O µчљЏ»№“ЇµƒpH“‘іўљшFe3+ЈҐ…ъЋЃљв…ъ≥…«в—хїѓћъ≥Ѕµн FeAsO4 Fe(OH)3 KCl ”√H2O2(їтCl2)іъћжKClO3 Zn-2e-![]() Zn2+
Zn2+
°Њљвќц°њ ‘ћвЈ÷ќц£Ї”…ћв÷––≈ѕҐњ…÷™£ђ–њ‘ьЊ≠ЈѕЋбЋбљюЇу∆д÷–µƒ–њЇЌ—хїѓ–њґЉ»№”ЏЋб÷–£ђ Cu2+±ї–њїє‘≠ќ™µ•÷ £ђЌ≠”л∆дЋы≤ї»№ќп–ќ≥…¬Ћ‘ь£ђєэ¬Ћ£ї»їЇуѕт¬Ћ“Ї÷–Љ”»л¬»ЋбЉЎЇЌ¬»їѓћъ≥э»•¬Ћ“Ї÷–µƒћъЇЌ…й£ђ¬»ЋбЉЎ∞—ЈѕЋбіш»лµƒFe2+ЇЌH3AsO3Ј÷±р—хїѓќ™Fe3+ЇЌH3AsO4£ђ¬»їѓћъ”лH3AsO4Јі”¶…ъ≥…ƒ—»№”ЏЋЃµƒFeAsO4£ђЉ”»л—хїѓ–њ «ќ™ЅЋµчљЏ»№“ЇµƒpH“‘іўљшћъјл„”ЋЃљв…ъ≥…«в—хїѓћъ≥Ѕµн°£ґюіќЊїїѓµƒƒњµƒ «ќ™ЅЋ≥э»•Pb2+µ»‘”÷ °£
£®1£©H3AsO3(—«…йЋб)÷–As‘™ЋЎµƒїѓЇѕЉџ «+3°£
£®2£©°∞љю≥ц°± ±Јі”¶≥Ў”¶‘ґјлїр‘і°£‘≠“т «Јі”¶≥Ў÷––њ”л—ќЋбЈі”¶£ђ”–“„»Љ“„±ђµƒH2…ъ≥…°£
£®3£©°∞“їіќЊїїѓ°±њ…“‘≥э»•Fe°ҐAs‘™ЋЎ£ђЉ”»лKClO3°ҐFeCl3≥э»•ћъ ±ЈҐ…ъЈі”¶µƒјл„”Јљ≥ћ љќ™KClO3+6FeCl2+6HCl ![]() 6FeCl3+KCl+3H2O£ђЉ”»лZnOµƒƒњµƒ «µчљЏ»№“ЇµƒpH°ҐіўљшFe3+ЈҐ…ъЋЃљв…ъ≥…«в—хїѓћъ≥Ѕµн£ђ∆д”аЈі”¶ќ™KClO3+3H3AsO3
6FeCl3+KCl+3H2O£ђЉ”»лZnOµƒƒњµƒ «µчљЏ»№“ЇµƒpH°ҐіўљшFe3+ЈҐ…ъЋЃљв…ъ≥…«в—хїѓћъ≥Ѕµн£ђ∆д”аЈі”¶ќ™KClO3+3H3AsO3 ![]() KCl+3H3AsO4 ЇЌFeCl3+H3AsO4
KCl+3H3AsO4 ЇЌFeCl3+H3AsO4![]() FeAsO4+3HCl£ђ“тіЋ£ђ¬Ћ‘ьAµƒ≥…Ј÷ «FeAsO4ЇЌFe(OH)3°£
FeAsO4+3HCl£ђ“тіЋ£ђ¬Ћ‘ьAµƒ≥…Ј÷ «FeAsO4ЇЌFe(OH)3°£
£®4£©°∞≤ъ∆Ј°±÷–µƒ÷ч“™‘”÷ «¬»ЋбЉЎµƒїє‘≠≤ъќпKCl°£ќ™ЅЋ±№√в≤ъ…ъ¬»їѓЉЎ’в÷÷‘”÷ £ђњ…“‘”√H2O2(їтCl2) іъћжKClO3°£
£®5£©–њЊџ±љ∞Јµз≥ЎЄЇЉЂ є”√µƒ «Єяіњґ»–њ∆ђ£ђ“‘ZnCl2ЇЌNH4Clќ™÷ч“™µзљв÷ °£–њЊџ±љ∞Јµз≥ЎЈ≈µз ±£ђЄЇЉЂ≤ƒЅѕ…ѕµƒµзЉЂЈі”¶ љќ™Zn-2e-![]() Zn2+°£
Zn2+°£