��Ŀ����
����Ŀ����ҵ����ˮ�ܿ���Ҫ�ɷ�ΪCo2O3������Fe��A1��Mg��Ca��Si��Ԫ�أ��Ʊ��ܵ������������ͼ��ʾ���ش��������⣺

��ؽ�������[co(Mn+)=0.1mol��L-1]�γ��������������pH��Χ���£�

��1��ˮ�ܿ��е�Fe��A1��Mg��CaԪ�صĴ�����̬Ϊ___�������̬������̬������
��2�������ܡ���Co2O3��Ӧ�����ӷ���ʽ��___������1�ijɷֿ�����___��
��3�����������м�Co2O3��������___��
��4������pH��Ϊ4.7-6֮�䣬������2Ϊ___��
��5����֪Ksp(CaF2)=5.3��10-9��Ksp(MgF2)=5.2��10-12�������ӡ���Ϊ�˳�ȥCa2+��Mg2+����ʱ�������ij�����___���ѧʽ����������![]() ���ֵΪ___���г���ʽ���ɣ���
���ֵΪ___���г���ʽ���ɣ���
��6��ʵ�������ڿ���������CoC2O4��̽������ʵ��ʱ��13.23gCoC2O4����___�����������ƣ��У���������ܵ�ij��������7.23g������CO2���ݴ�Ԥ�⣺����������Co���ϼ۵Ŀ��������___����ʵ����д���һ����֤��
���𰸡�����̬ Co2O3+ SO32-+4H+=2Co2++ SO42-+2 H2O SiO2 ��Fe2+����ΪFe3+ Fe��OH��3��Al��OH��3 MgF2 ![]() ���� +2��+3��+2��+4
���� +2��+3��+2��+4
��������
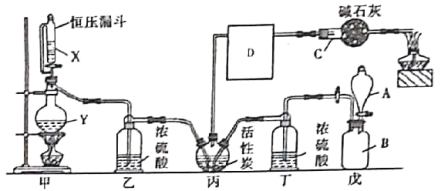
�������̣�Co2O3�����̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ�أ��������������Na2SO3�������ܻ�ԭ�ɶ����ܣ�SiO2���������ᣬ���ˣ�����1����SiO2����Һ����Co2+��Fe2+��Fe3+��Al3+��Mg2+��Ca2+������Co2O3��Fe2+����ΪFe3+�����백ˮ����pH4.7��6֮�䣬��ȥFe3+��Al3+������2ΪFe��OH��3��Al��OH��3������CoF2����MgF2������ȥMg2+��Ca2+������3ΪMgF2��CaF2����Һ��Ҫ����Co2+������(NH4)2C2O4����CoC2O4������CoC2O4�õ���Co�����
��1��ˮ�ܿ��ǹ��壬Fe��A1��Mg��CaԪ�صĴ�����ֻ̬���ǻ���̬��
��2��Co2O3�������������Na2SO3�������ܻ�ԭ�ɶ����ܣ����ӷ���ʽΪ��Co2O3+ SO32-+4H+=2Co2++ SO42-+2 H2O��SiO2���������ᣬ���ˣ�����1����SiO2��
��3����������������Co2O3��Ϊ�˽�Fe2+����ΪFe3+�����백ˮ����pH4.7��6֮�䣬��ȥFe3+��
��4����Һ����Co2+��Fe2+��Fe3+��Al3+��Mg2+��Ca2+������Co2O3��Fe2+����ΪFe3+�����백ˮ����pH4.7��6֮�䣬��ȥFe3+��Al3+������2ΪFe��OH��3��Al��OH��3��
��5������������Ϊ�˳�ȥCa2+��Mg2+���������ܽ�Ƚ�С�ij�������������MgF2����Mg2+�պ���ȫ����ʱ��![]() ��ֵ���ʱKsp��MgF2��=c��Mg2+����c2��F-��=5.2
��ֵ���ʱKsp��MgF2��=c��Mg2+����c2��F-��=5.2![]() 10-12��c��Mg2+��=1.0��10-5mol/L��c2��F-��=5.2��10-7��Ksp��CaF2��=c��Ca2+����c2��F-��=5.3��10-9��c��Ca2+��=5.3��10-9����5.2
10-12��c��Mg2+��=1.0��10-5mol/L��c2��F-��=5.2��10-7��Ksp��CaF2��=c��Ca2+����c2��F-��=5.3��10-9��c��Ca2+��=5.3��10-9����5.2![]() 10-7������ʱ��Һ��c��Ca2+�������
10-7������ʱ��Һ��c��Ca2+�������![]() =
=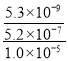 =
=![]() ��
��
��6������CoC2O4��Ҫ�������н��У�13.23gCoC2O4�����ʵ���n= ![]() =0.09mol����Ԫ������Ϊ��0.09mol ��4��16g/mol=5.76g�����ܵ�������Ļ�ѧʽΪCoxOy������0.18molCO2��������̼����Ԫ������Ϊ��0.36mol��16g/mol=5.76g���������غ��֪����CoC2O4�Ĺ�����������������Ϊ0.18��44g+7.23g-13.23g=1.92g���������������ʵ���Ϊ
=0.09mol����Ԫ������Ϊ��0.09mol ��4��16g/mol=5.76g�����ܵ�������Ļ�ѧʽΪCoxOy������0.18molCO2��������̼����Ԫ������Ϊ��0.36mol��16g/mol=5.76g���������غ��֪����CoC2O4�Ĺ�����������������Ϊ0.18��44g+7.23g-13.23g=1.92g���������������ʵ���Ϊ![]() =0.06mol�����շ���ʽΪ��9CoC2O4+6O2=CoxOy+18 CO2����x=9��y=12������ܵ�������Ļ�ѧʽΪCo9O12���ɻ��ϼ۴�����Ϊ0��֪��Co��ƽ����̬Ϊ2.67����Co9O12��Co�����Ҫ����2.67����ͼ�ҪС��2.67������Co�ļ�̬������+2��+3��+2��+4��
=0.06mol�����շ���ʽΪ��9CoC2O4+6O2=CoxOy+18 CO2����x=9��y=12������ܵ�������Ļ�ѧʽΪCo9O12���ɻ��ϼ۴�����Ϊ0��֪��Co��ƽ����̬Ϊ2.67����Co9O12��Co�����Ҫ����2.67����ͼ�ҪС��2.67������Co�ļ�̬������+2��+3��+2��+4��

����Ŀ���Ȱ���һ�ֳ�Ч����ˮ����������Ҫ����һ�Ȱ������Ȱ������Ȱ�(NH2Cl��NHCl2��NCl3)����ҵ�Ͽ�����NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)�Ʊ�һ�Ȱ����ش��������⣺
NH2Cl(g)+HCl(g)�Ʊ�һ�Ȱ����ش��������⣺
��1���Ȱ�������ˮ����������Ϊˮ�����ɾ���ǿ��ɱ�����õ����ʣ���������___�����Ȱ���ˮ��Ӧ�Ļ�ѧ����ʽΪ___��
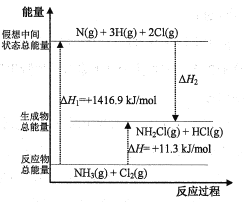
��2����֪���ֻ�ѧ���ļ��ܺͻ�ѧ��Ӧ�������仯�������ͼ��ʾ�����Բ�ͬ������ͬ�ֻ�ѧ�����ܵ�ϸ��𣩡�
��ѧ�� | N-H | N-Cl | H-Cl |
���ܣ�kJ/mol�� | 391.3 | x | 431.8 |
����H2=___kJ/mol��x=___��
��3�����ܱ������з�ӦNH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)�ﵽƽ�⣬�ݴ˷�Ӧͨ������ѧ���ɼ���������NH2Cl�����������
NH2Cl(g)+HCl(g)�ﵽƽ�⣬�ݴ˷�Ӧͨ������ѧ���ɼ���������NH2Cl�����������![]() �����ȱȣ��ı仯������ͼ��ʾ��
�����ȱȣ��ı仯������ͼ��ʾ��
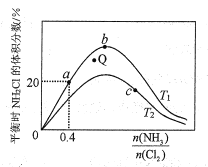
��a��b��c�����Ӧƽ�ⳣ���Ĵ�С��ϵ��___��T1�¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ___���г���ʽ���ɣ���
����T2�¶��£�Q���Ӧ�����ʣ�v��___v��������ڡ���С�ڡ����ڡ�����
���ڰ��ȱ�һ��ʱ�����NH3��ת���ʵķ�����___����д1��)
�������ﶼ�����壬ʵ����NH2Cl���������ʼ�ձ�����ֵ�ͣ�ԭ�������___��
����Ŀ����֪��pAg��-lgc(Ag+)��pX��-lg c(Xn-)��298Kʱ���������ʵ�Ksp���±���
��ѧʽ | AgCl | AgSCN | Ag2CrO4 |
��ɫ | �� | dz�� | �� |
Ksp | 1.8��1010 | 1.0��1012 | 2.0��1012 |
AgCl��AgSCN��Ag2CrO4�ı�����Һ�У������Ӻ������ӵ�Ũ�ȹ�ϵ��ͼ��ʾ������˵����ȷ����
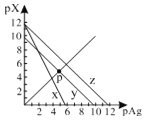
A.ͼ��x����AgCl���ߣ�z����AgSCN����
B.298Kʱ����Cl����CrO42�������ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����Һ�У���������0.1mol/L��AgNO3��Һ�����Ȳ������Ǻ�ɫ����
C.298Kʱ������p���������Ũ�ȣ���y�ϵĵ������������ƶ�
D.298KʱAg2CrO4(s)��2SCN��(aq) ![]() 2AgSCN(s)��CrO42- (aq)��ƽ�ⳣ��K��2.0��1012
2AgSCN(s)��CrO42- (aq)��ƽ�ⳣ��K��2.0��1012