题目内容
【题目】光气是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气很容易水解,熔点为-118°C,沸点为8.2°C。某科研小组模拟工业生产由一氧化碳和氯气的混合物在活性炭作催化剂的条件下制取光气,其反应原理为:Cl2+CO=COCl2。装置如图所示(丙处的加油装置已省略,D中仪器用于收集光气)。
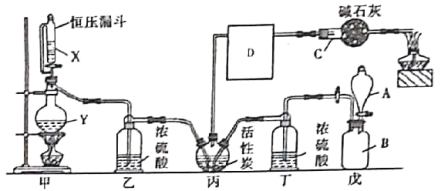
(1)仪器C的名称为___,其中碱石灰的作用为________________,D中仪器应浸在_____(填“冰水浴”或“热水浴”)中。
(2)仪器组装完成后,检验甲装置气密性的方法是_________。
(3)戊装置主要用于制取氯气,用酸性KMnO4和盐酸制取氯气时的离子方程式为__________。
(4)光气极易水解,遇水后易产生一种氢化物和一种氧化物,其反应的化学方程式为______。
【答案】球形干燥管 吸收Cl2和HCl,防止大气污染 冰水浴 塞好恒压漏斗上面的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热烧瓶,若导管口有气泡生成,停止加热时,导管口有一端稳定的液柱,则表明气密性良好 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O COCl2+H2O=CO2+2HCl
【解析】
(1)根据装置图判断仪器名称及装置的作用;
(2)利用微热法减压装置的气密性;
(3)酸性KMnO4和盐酸在常温下可制取氯气,并且不用担心盐酸浓度降低反应停止的问题;
(4)光气极易水解,与水生成HCl和CO2。
(1)根据装置图可知仪器C为球形干燥管;碱石灰可吸收反应产生的Cl2和HCl,防止大气污染;装置D应浸在冰水浴中,防止空气中水蒸气进入D中使光气水解;
(2)塞好恒压漏斗上面的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热烧瓶,若导管口有气泡生成,停止加热时,导管口有一端稳定的液柱,则表明气密性良好;
(3)酸性KMnO4和盐酸在常温下可制取氯气,反应方程式为:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)光气极易水解,与水生成HCl和CO2,反应方程式为COCl2+H2O=CO2+2HCl
方法 | 微热法 | 液差法 | 气压法 |
原理 | 升高装置中气体的温度,使气体体积膨胀 | 缩小装置中气体的体积,增大压强 | 封闭气体压强增大,使液滴不能滴下 |
图示 |
|
|
|
具体 操作 | 塞紧橡胶塞,将导气管末端伸入盛水的烧杯中,用手捂热(或用酒精灯微热)烧瓶 | 塞紧橡胶塞,用止水夹夹住导气管的橡胶管部分,从长颈漏斗向试管中注水 | 塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向烧瓶中加水 |
现象 说明 | 烧杯中有气泡产生,停止微热,冷却后导气管末端形成一段水柱,且保持一段时间不下降 | 停止加水后,长颈漏斗中的液面高于试管中的液面,且一段时间内液面差不变 | 一段时间后,液滴不能滴下 |

 阅读快车系列答案
阅读快车系列答案