题目内容
【题目】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为_____________(任写一种)。
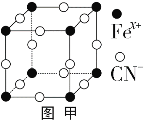
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。
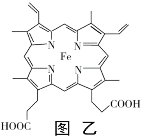
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________

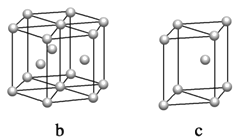
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
【答案】[Ar]3d5(或1s22s22p63s23p63d5) CO2或CS2 1∶1 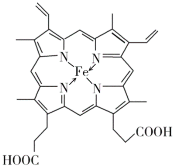 六方最密堆积 c 12 NAaρ g/mol
六方最密堆积 c 12 NAaρ g/mol
【解析】
(1)铁元素是26号元素,其核外电子排布式为[Ar]3d64s2,失电子先失去最外层电子,然后书写Fe3+基态电子排布式;
(2)根据等电子体的定义进行分析;
(3)平均每两个晶胞立方体中含有1个K+,说明每个晶胞中含有![]() 个K+,然后用均摊方法得到Fex+和CN-的个数,求出化学式,最后判断出Fe2+和Fe3+的个数比;
个K+,然后用均摊方法得到Fex+和CN-的个数,求出化学式,最后判断出Fe2+和Fe3+的个数比;
(4)N最外层有5个电子,形成三个共价键达到饱和,多余的键为配位键,进行分析;
(5)根据图a,镁单质堆积方式为六方最密堆积,配位数为12,然后根据密度定义进行分析;
(1)铁是26号元素,其原子核外有26个电子,根据构造原理其核外电子排布式为[Ar]3d64s2,则Fe3+的基态核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5);
(2)SCN中含有3个原子,且其价电子数是16,与SCN互为等电子体的一种非极性分子的为CO2(或CS2);
(3)平均每两个晶胞立方体中含有一个K+,所以一个晶胞中钾离子个数=![]() =0.5,该立方体中铁原子个数=8×
=0.5,该立方体中铁原子个数=8×![]() =1,CN位于每条棱中点,该立方体中含有CN个数=12×
=1,CN位于每条棱中点,该立方体中含有CN个数=12×![]() =3,平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,即亚铁离子与铁离子之比是1:1;
=3,平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,即亚铁离子与铁离子之比是1:1;
(4)配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+提供空轨道,N原子提供电子对,Fe2+与N原子间的的配位键为: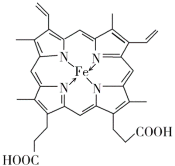 ;
;
(5)镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,单质晶体中原子为六方最密堆积,配位数为12,晶胞是图中的c;晶胞质量=2![]() g,则ρg·cm3=
g,则ρg·cm3=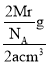 ,则有Mr=NAaρ g/mol。
,则有Mr=NAaρ g/mol。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案