题目内容
【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
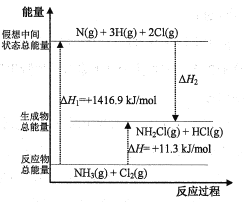
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
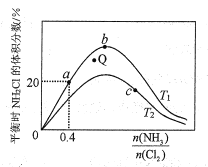
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。
【答案】HClO NHCl2+2H2O ![]() NH3 +2HClO -1405.6 191.2 Ka=Kb>Kc或a=b>c
NH3 +2HClO -1405.6 191.2 Ka=Kb>Kc或a=b>c ![]() 小于 加热(或者及时移出产物) 有副产物生成,如NHCl2、NCl3、N2等
小于 加热(或者及时移出产物) 有副产物生成,如NHCl2、NCl3、N2等
【解析】
(1)氯胺中N为-3价,Cl为+1价,在水中水解生成一种有强氧化性的物质,说明生成HClO;NHCl2水解生成氨气和次氯酸,其水解的离子方程式为NHCl2+2H2O ![]() NH3 +2HClO;
NH3 +2HClO;
(2)根据图中内容,可以看出:ΔH2=-(ΔH1-ΔH)=ΔH-ΔH1=11.3kJ/mol-1416.9 kJ/mol=-1405.6 kJ/mol;根据图中内容,可以看出NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g) △H=+11.3kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molNCl键所需的能量为x,新键生成释放的能量ΔH2=-(391.3×2+x+431.8)kJ/mol=-1405.6kJ/mol,解得x=191.2;
NH2Cl(g)+HCl(g) △H=+11.3kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molNCl键所需的能量为x,新键生成释放的能量ΔH2=-(391.3×2+x+431.8)kJ/mol=-1405.6kJ/mol,解得x=191.2;
(3)①反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)是吸热反应,a和b温度一致,平衡常数相等,c点NH2Cl的体积分数减小,平衡常数减小,温度应该升高,所以Ka=Kb>Kc或a=b>c;T1温度下,
NH2Cl(g)+HCl(g)是吸热反应,a和b温度一致,平衡常数相等,c点NH2Cl的体积分数减小,平衡常数减小,温度应该升高,所以Ka=Kb>Kc或a=b>c;T1温度下,![]() =0.4时,NH2Cl的体积分数为20%,设n(NH3)=0.4a,n(Cl2)=a,则有;
=0.4时,NH2Cl的体积分数为20%,设n(NH3)=0.4a,n(Cl2)=a,则有;
NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)
NH2Cl(g)+HCl(g)
起始(mol)0.4a a 0 0
转化(mol)x x x x
平衡(mol)0.4a-x a-x x x
NH2Cl的体积分数=![]() =20%,x=0.28a,平衡常数K=
=20%,x=0.28a,平衡常数K= ![]() =
= ![]() =
= ![]() ;
;
②在T2温度下,Q点相当于加入部分NH2Cl,则v正不变,v逆增大,故v正小于v逆;
③在氨氯比一定时,该反应吸热,可以加热来提高NH3的转化率,或者及时移出产物NH2Cl和HCl;
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是有副产物生成,如NHCl2、NCl3、N2等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。