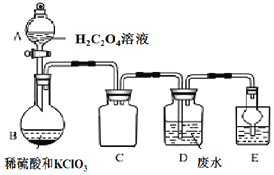
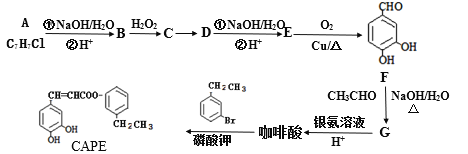
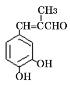
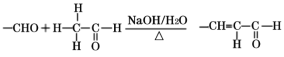题目内容
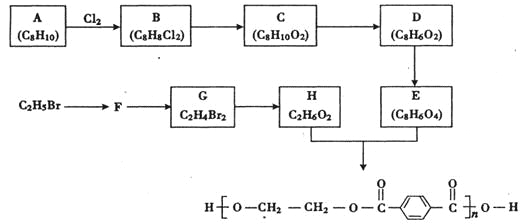
【题目】如图为实验室电解Na2SO4溶液的装置,下列叙述错误的是( )
A.阴极:2H++2e-=H2↑,阳极:4OH--4e-=2H2O+O2↑
B.电解一段时间后,阴极区显碱性,阳极区显酸性
C.电解过程中,Na+、H+向阴极定向移动,SO42-、OH-向阳极定向移动
D.电解后,撤掉阴离子交换膜充分混合,Na2SO4溶液的浓度比电解前增大
【答案】C
【解析】
电解Na2SO4溶液,相当于电解水,故电解时,阳极:4OH--4e-=2H2O+O2↑,阴极:4H++4e-=2H2↑,其中阴极区H+放电,H+浓度减小,使水的电离平衡向右移动促进水的电离,OH-浓度增大.在阴极和阳极之间有阴离子交换膜,只允许阴离子OH-、![]() 通过。
通过。
A.通电时,Na+、H+移向阴极,H+得电子被还原,OH-、![]() 移向阳极,OH-失电子被氧化,故A正确;
移向阳极,OH-失电子被氧化,故A正确;
B.由于H+在阴极上放电,阴极区c(OH-)增大,OH-在阳极上放电,阳极区c(H+)增大,故B正确;
C.Na+、H+不能通过阴离子交换膜,故C错误;
D.电解Na2SO4溶液实质是电解水,最终Na2SO4溶液浓度增大,故D正确;
答案选C。

【题目】氯化亚铜(![]() )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含![]() 、
、![]() 、
、![]() 、
、![]() )生产
)生产![]() 的流程如图所示:
的流程如图所示:
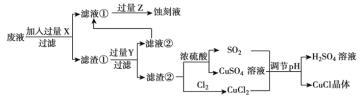
根据以上信息回答下列问题:
(1)生产过程中:X是________,Z是________。(均填化学式)
(2)写出生成![]() 的离子方程式________。
的离子方程式________。
(3)析出的![]() 晶体不用水而用无水乙醇洗涤的原因是________。
晶体不用水而用无水乙醇洗涤的原因是________。
(4)在![]() 的生成过程中理论上不需要补充SO2气体,其理由是________。
的生成过程中理论上不需要补充SO2气体,其理由是________。
(5)已知:常温下![]() ,
,![]() ,现向
,现向![]() 饱和溶液中加入
饱和溶液中加入![]() 固体至
固体至![]() ,此时溶液中
,此时溶液中![]() =________。
=________。
(6)实验探究pH对![]() 产率的影响如下表所示:
产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出![]() 晶体最佳pH为________,当pH较大时
晶体最佳pH为________,当pH较大时![]() 产率变低的原因是________。
产率变低的原因是________。
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。