��Ŀ����
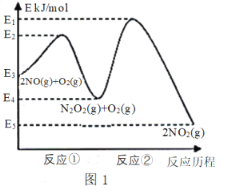
����Ŀ����������������ɴ�����Ⱦ����Ҫ���ʡ��о���������ķ�Ӧ������������������Ⱦ����Ҫ���塣NO�ڿ����д������·�Ӧ��2NO(g)+ O2(g)![]() 2NO2(g) ��H������Ӧ��������ɣ���ͼ1��ʾ��
2NO2(g) ��H������Ӧ��������ɣ���ͼ1��ʾ��
�ش��������⣺
(1)д����Ӧ�ٵ��Ȼ�ѧ����ʽ(��H�ú�������E�ĵ�ʽ��ʾ)��___________��
(2)��Ӧ�ٺͷ�Ӧ���У�һ���ǿ췴Ӧ������ٽ���ƽ��״̬������һ��������Ӧ������2NO(g)+O2(g)![]() 2NO2(g)��Ӧ���ʵ���_______(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������_________(��Ӧδʹ�ô���)��
2NO2(g)��Ӧ���ʵ���_______(������Ӧ����������Ӧ����)���Ը÷�Ӧ��ϵ�����¶ȣ������ܷ�Ӧ���ʱ�������ԭ�������_________(��Ӧδʹ�ô���)��
(3)T1�¶�ʱ���ݻ�Ϊ2L�ĺ����ܱ�������ֻ����1.00molNO2���巢����Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)�����
2NO2(g)��ʵ���ã�v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ�졣��ͬʱ�̲��������n(NO2)�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
�ٴ�0��2s�÷�Ӧ��ƽ������v(NO2)=___________mol/(L��s)��
��T1�¶�ʱ��ѧƽ�ⳣ��K=___________mol��1��L��
�ۻ�ѧƽ�ⳣ��K�����ʳ���k����k������ѧ��ϵ��K=___________�������������¶ȸı�ΪT2ʱ��k��=k������T1__________T2 (����>������<������=��)��
���𰸡�2NO(g) ![]() N2O2(g) ��H = -(E3-E4) kJ/ mol ��Ӧ�� �����ܷ�Ӧ���ʵ��Ƿ�Ӧ�ڣ��¶����ߺ�Ӧ��ƽ�������ƶ������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬N2O2Ũ�ȼ�С���·�Ӧ�����ʱ��� 0.0875 8 k��/k�� <
N2O2(g) ��H = -(E3-E4) kJ/ mol ��Ӧ�� �����ܷ�Ӧ���ʵ��Ƿ�Ӧ�ڣ��¶����ߺ�Ӧ��ƽ�������ƶ������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬N2O2Ũ�ȼ�С���·�Ӧ�����ʱ��� 0.0875 8 k��/k�� <
��������
��1������ͼ���֪��Ӧ��Ϊ2NO��g��N2O2��g�������ʱ��H=��E2-E3��kJ/mol��
��2������ͼ���֪����Ӧ�ٵĻ��<��Ӧ�ڵĻ�ܣ���Ӧ��Ϊ�췴Ӧ����Ӧ��Ϊ����Ӧ�������÷�Ӧ���ʵ�������Ӧ��
��������Ӧ���ʵ��Ƿ�Ӧ�ڣ������¶Ⱥ�Ӧ��ƽ�������ƶ������N2O2Ũ�ȼ�С�����¶����߶�Ӧ��Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ�죻
��3������v=��c/��t�����ǰ5s��v��NO2����֮��v��O2��=1/2v��NO2�����㣻
2NO2��g��2NO��g��+O2��g��
��ʼ��mol/L��0.04 0 0
ת����mol/L��0.02 0.02 0.01
ƽ�⣨mol/L��0.02 0.02 0.01
���¶��¸÷�Ӧ��ƽ�ⳣ��K=0.022��0.01/0.022=0.01��2NO+O22NO2�Ļ�ѧƽ�ⳣ����2NO2��g��2NO��g��+O2��g����ƽ�ⳣ����Ϊ������
(1)����ͼ���֪��Ӧ�ٵĻ�ѧ����ʽΪ��2NO(g)N2O2(g)��H=(E2E3)kJ/mol��
�ʴ�Ϊ��2NO(g)N2O2(g)��H=(E2E3)kJ/mol��
(2)����ͼ���֪,��Ӧ�ٵĻ��<��Ӧ�ڵĻ��,��Ӧ��Ϊ�췴Ӧ,��Ӧ��Ϊ����Ӧ,����2NO(g)+O2(g)2NO2(g)��Ӧ���ʵ�������Ӧ�ڣ�
�Ը÷�Ӧ���������¶�,�����ܷ�Ӧ���ʱ���,����ԭ���ǣ���������Ӧ���ʵ��Ƿ�Ӧ��,�����¶Ⱥ�Ӧ��ƽ�������ƶ�,���N2O2Ũ�ȼ�С,�¶����߶�Ӧ��Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ��,N2O2Ũ�ȼ�С���·�Ӧ�����ʱ�����
�ʴ�Ϊ����Ӧ��;��������Ӧ���ʵ��Ƿ�Ӧ��,�����¶Ⱥ�Ӧ��ƽ�������ƶ�,���N2O2Ũ�ȼ�С,�¶����߶�Ӧ��Ӧ�ڵ�Ӱ������N2O2Ũ�ȼ�С��Ӱ��,N2O2Ũ�ȼ�С���·�Ӧ�����ʱ�����
(3)ǰ5s��v(NO2)=0.04mol/L0.03mol/L5s=0.002mol/(Ls),
��v(O2)=12v(NO2)=0.001mol/(Ls)��
2NO2(g)2NO(g)+O2(g)
��ʼ(mol/L)0.04 1 0
ת��(mol/L)0.02 0.35 0.35
ƽ��(mol/L)0.02 0.65 0.35
��0��2s�÷�Ӧ��ƽ������v(NO2)=0.35/2/2=0.0875 mol/(L��s)
�ʴ�Ϊ��0.0875 mol/(L��s)
�� ��Ӧ���д�4-5��ʱ�ﵽƽ��״̬
2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
��ʼ(mol/L)0.04 0 0 1
ת��(mol/L)0.02 0.50 0.25 0.50
ƽ��(mol/L)0.02 0.5 0.25 0.50
�ij�Ũ��Ϊ 0.25 0.125 0.25
���¶��¸÷�Ӧ��ƽ�ⳣ��K=0.25��0.25/0.25��0.25��0.125=8
��2NO+O22NO2�Ļ�ѧƽ�ⳣ��K==8��
�ʴ�Ϊ��8
������v��=k��c2(NO)��c(O2)��v��=k��c2(NO2)��k����k��Ϊ���ʳ���ֻ���¶�Ӱ��
��ѧƽ�ⳣ��K�����ʳ���k����k������ѧ��ϵ��K= k��/k��
�����������¶ȸı�ΪT2ʱ��k��=k������ƽ�������ƶ�����T1<T2
�ʴ�Ϊ��k��/k�棻T<T

����Ŀ����T��ʱ����1 L�̶�������ܱ�����M�м���2 mol X��1 mol Y���������·�Ӧ��2X(g)��Y(g) ![]() aZ(g)��W(g)����H����Q kJ/mol(Q>0)���÷�Ӧ�ﵽƽ��ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����ش��������⣺
aZ(g)��W(g)����H����Q kJ/mol(Q>0)���÷�Ӧ�ﵽƽ��ų�������ΪQ1 kJ������X��ת����Ϊ������ƽ����������¶ȣ���������ƽ����Է���������С����ش��������⣺
(1)��ѧ������a��ֵΪ________��
(2)������˵���÷�Ӧ�ﵽ�˻�ѧƽ��״̬����________(�����)��
a��������ѹǿһ�� b��������������ܶ�һ��
c��������Z�ķ�����һ�� d�����������������һ��
(3)ά��T���¶Ȳ��䣬����ʼʱ������M�м���2 mol X��1 mol Y��1 mol Ar(ϡ�����岻���뷴Ӧ)����Ӧ�ﵽƽ���ų���������________kJ��
(4)ά��T���¶Ȳ��䣬����һ����ԭ���������ȵĺ�ѹ����N�м���2 mol X��1 mol Y�����������Ӧ���ﵽƽ�⣬��________(����M������N��)�����еķ�Ӧ�ȴﵽƽ��״̬��������X����������M________N(����>������<����������)��
(5)��֪���÷�Ӧ��ƽ�ⳣ�����¶ȵı仯��������ʾ��
�¶�/�� | 200 | 250 | 300 | 350 |
ƽ�ⳣ��K | 9.94 | 5.2 | 1 | 0.5 |
����ij�¶��£�2 mol X��1 mol Y������M�з�Ӧ���ﵽƽ�⣬X��ƽ��ת����Ϊ50%������¶�Ϊ________����