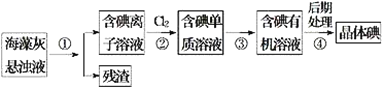
题目内容
【题目】在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定 b.容器内气体的密度一定
c.容器内Z的分子数一定 d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2 mol X和1 mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为________℃。
【答案】1 ac Q1 N > 350
【解析】
(1)该反应是一个放热反应,升高温度平衡向逆反应方向移动,混合气体的平均相对分子质量减小,则气体反应物计量数之和大于气体生成物计量数之和;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(3)反应物的浓度不变,则其转化率不变,放出的热量不变;
(4)根据减少的分子数计算参加反应的X的物质的量,根据X和反应热之间的关系式计算;
(5)该条件下,恒压与恒容相比,相当于增大压强,增大压强平衡向正反应方向移动,压强越大,反应速率越大,据此判断到达平衡时间,根据平衡移动方向判断X的质量分数;
(6)计算该温度下的平衡常数,根据表格中平衡常数和温度的关系判断.
1)该反应是一个放热反应,升高温度平衡向逆反应方向移动,混合气体的平均相对分子质量减小,则气体反应物计量数之和大于气体生成物计量数之和,所以a=1,故答案为:1;
(2)A、由于反应前后气体的化学计量数之和不相等,则平衡时压强不再发生变化,故A正确;
B. 由于是在固定体积的容器中反应,则无论是否达到平衡状态,密度都不变,故B错误;
C. 反应达到平衡状态时,物质的浓度、含量、质量等不再发生变化,则平衡时容器内Z分子数一定,故C正确;
D. 反应物和生成物都是气体,无论是否达到平衡状态,容器内气体的质量都一定,故D错误。
故答案为:AC;
(3)若起始时向容器M中加入2mol X、1mol Y和1mol Ar(稀有气体不参与反应),X和Y的浓度不变,所以其转化率不变,该反应达到平衡状态时,放出的热量不变为Q,故答案为:Q;
(4)同一容器中,物质的分子数之比等于物质的量之比,当反应达到平衡时容器内的分子数目减少10%时,气体的物质的量减少10%,即气体的物质的量减少(4+6)mol×10%=1mol,根据2X(g)+Y(g)Z(g)+W(g)知,当气体的物质的量减少1mol时参加反应的X的物质的量是2mol,则反应中放出的热量为QkJ,故答案为:Q;
(5)该条件下,恒压与恒容相比,相当于增大压强,压强越大,反应速率越大,反应到达平衡的时间越短,增大压强平衡向正反应方向移动,则X的质量发生越小,
故答案为:N;>;
(6)2mol X和1mol Y在容器M中反应并达到平衡,x的平衡转化率为50%,则平衡时,c(X)=(150%)×2mol1L=1mol/L,
C(Y)=1mol1mol×121L=0.5mol/L,
c(Z)=c(W)=1/2×(2×50%)mol/L=0.5mol/L,
k=0.5×0.5/(0.5×12)=0.5,
所以其温度是350℃,故答案为:350℃。

 名校课堂系列答案
名校课堂系列答案【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g) △H上述反应分两步完成,如图1所示。
2NO2(g) △H上述反应分两步完成,如图1所示。
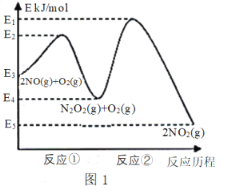
回答下列问题:
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
(3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。