题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下2.24LSO3溶于水生成0.1mol![]()
B.6.4g由SO2和S2组成的混合物含有的原子数大于0.2NA
C.1mol锌和足量的浓H2SO4完全反应,转移的电子数小于2NA
D.12g金刚石(C)中含有的共价键数目为4NA
【答案】B
【解析】
A.SO3在标准状况下为固体,不能利用气体摩尔体积来计算其物质的量,因此标况下,2.24LSO3其物质的量大于0.1mol,溶于水生成的SO42-也大于0.1mol,A错误;
B.SO2和S2的摩尔质量相同,均为64g·mol-1,则6.4g混合物,其含有分子的物质的量为0.1mol,由于1molSO2含有3mol原子,1molS2含有2mol原子,因此0.1molSO2和S2构成的混合物含有的原子数在0.2NA~0.3NA之间,大于0.2NA,B正确;
C.Zn和浓硫酸反应生成SO2,随着反应的进行,硫酸浓度减小,变成稀硫酸,Zn和稀硫酸生成H2,但是Zn不管和浓硫酸还是稀硫酸反应,均生成ZnSO4,1molZn转变成Zn2+,转移2mol电子,因此1molZn和足量浓硫酸反应,转移的电子数为2NA,C错误;
D.在金刚石中,1molC形成4molC-C,而1个C-C键周边有2个C原子,可知C原子和C—C的比例为1:2,则12g金刚石中含有2molC-C,其数目为2NA,D错误;
答案选B。

【题目】下表是元素周期表中的一部分,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ | ⑿ |
(1)写出下列元素名称①_______,⑤_______,⑨_______,⑾________。
(2)在这些元素中,金属性最强的元素是_______;除稀有气体元素以外的元素中原子半径最大的是_______,原子半径最小的是______。其氢化物最稳定的是____。(填写元素符号)
(3)元素②和③形成的离子的电子层结构_________(填“相同”或“不相同”),两者形成的化合物是否是离子化合物________(填“是”或否”),该化合物的电子式为______________。
(4)元素⑧的最高价氧化物对应的水化物化学式为:______名称为______:。
(5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是_________(填写化学式),写出其和盐酸反应的化学方程式__________________________________________。
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g) △H上述反应分两步完成,如图1所示。
2NO2(g) △H上述反应分两步完成,如图1所示。
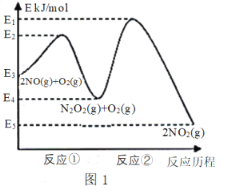
回答下列问题:
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
(3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的反应有:
反应Ⅰ:C3H8(g)C3H6(g)+H2(g) △H1
反应Ⅱ:2C3H8(g)3C2H4(g)+2H2(g) △H2
已知:①反应Ⅰ活化能Ea(Ⅰ)小于反应Ⅱ活化能Ea(Ⅱ);
②3种物质的燃烧热如下表:
C3H8(g) | C3H6(g) | H2(g) |
—2217.8kJ·mol-1 | —2058kJ·mol-1 | —285.8kJ·mol-1 |
(1)△H1=_______kJ·mol-1
(2)恒温恒容条件下,向密闭容器中充入1molC3H8(g),下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是______________。
A.该反应的H保持不变B.混合气体的平均摩尔质量保持不变
C.![]() 保持不变D.C3H8分解速率与C3H6消耗速率相等
保持不变D.C3H8分解速率与C3H6消耗速率相等
(3)一定温度下,向恒容密闭容器中充入总物质的量为4mol的丙烷和氢气混合气体(氢气的作用是活化催化剂)。反应相同时间,丙烯产率与进料气的关系如图1所示。图中曲线升高的原因是______________。
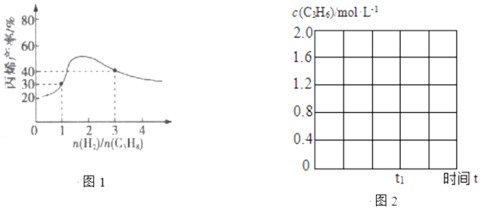
(4)①反应温度600℃,将10molC3H8(g)充入2L的刚性容器中,丙烷平衡转化率与丙烯的选择性均为40%,则反应Ⅰ的平衡常数K=______________。(保留2位小数)(丙烯的选择性=![]() ×100%)
×100%)
②600℃,丙烷脱氢反应在t1时达平衡,请在图2中画出该条件下c(C3H6)随时间t的变化图。______________
(5)含一氯丙烷(C3H7Cl)的废水可通过加入适量乙酸钠,设计成微生物电池除去,其原理如图3所示。写出N电极的电极反应式______________。