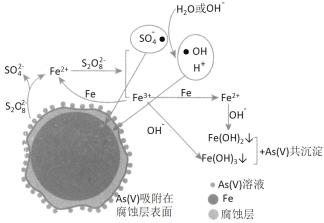
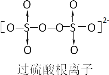
题目内容
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:

(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
【答案】②⑤ 100mL容量瓶 偏小 偏大 偏小 2 1.2mg/mL
【解析】
(1)根据配制一定物质的量浓度的溶液的正确操作结合图示分析解答;
(2)容量瓶是确定溶液体积的仪器;
(3)依据仰视刻度线,会使溶液体积偏大判断,结合C=![]() 分析;
分析;
(4)草酸跟酸性KMnO4溶液反应生成二氧化碳、二价锰离子等,结合氧化还原反应得失电子守恒和根据电荷守恒进行分析写出化学方程式得到x;
(5)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度。
(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,
故答案为:②⑤;
(2) 配制l00m L酸性KMnO4标准溶液应该用100mL容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小;如未冷却至室温就进行液体转移,液体热胀冷缩,冷却后则其所配的氯化钾溶液的浓度偏大;若用托盘天平时错把砝码放在左边,把药品放在右边称量,会导致溶质的物质的量偏小,则其所配氯化钾溶液的浓度将偏小;
(4) 草酸跟KMnO4反应的离子方程式为:2MnO4+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,根据电荷守恒,(1×2)+(+1×6)=+x×2,解得x=2;
(5)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×104mol,根据反应方程式2MnO4+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=![]() n(MnO4)=2.5×2.4×104mol=6×104mol,Ca2+的质量为:40g/mol×6×104mol=0.024g,钙离子的浓度为:
n(MnO4)=2.5×2.4×104mol=6×104mol,Ca2+的质量为:40g/mol×6×104mol=0.024g,钙离子的浓度为:![]() = 1.2mg/mL。
= 1.2mg/mL。

 字词句段篇系列答案
字词句段篇系列答案【题目】根据下表中实验操作、现象得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向饱和Na2CO3溶液中加入BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸 | 产生气泡 | Ksp(BaCO3)<Ksp(BaSO4) |
B | 向FeCl3溶液中滴加NaI溶液,然后滴加CCl4,振荡并静止 | 有机层出现紫 红色 | 氧化性:Fe3+>I2 |
C | 向Na2CO3溶液中滴加盐酸,将产生的气体通入硅酸钠溶液 | 溶液中出现白色沉淀 | 非金属性:Cl>C>Si |
D | 将碳与浓硫酸共热产生的气体通入酸性KMnO4溶液 | 溶液紫红色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D