题目内容
【题目】食用香味剂是常见的食品添加剂之一。以苯酚为原料合成某食用香味剂(J)的路线:

回答下列问题:
(1)B的名称是__________。反应⑦的类型属于__________。
(2)E中官能团名称是__________。若C与乙二醇(![]() )发生缩聚反应生成高聚物H,则H的结构简式为__________。
)发生缩聚反应生成高聚物H,则H的结构简式为__________。
(3)F的结构简式为__________。
(4)与反应⑧相似,![]() (甲基环丙基酮)被CF3COOOH(三氟过氧乙酸)氧化生成的主要产物是__________。
(甲基环丙基酮)被CF3COOOH(三氟过氧乙酸)氧化生成的主要产物是__________。
(5)R是G的同分异构体。R能发生银镜反应,核磁共振氢谱为三组峰,峰面积之比为9:6∶1,R可能的结构简式为_____________________。
(6)根据上述流程中合成食用香味剂(J)的原理,设计由![]() 制备
制备![]() 的合成路线。(无机试剂任选)__________。
的合成路线。(无机试剂任选)__________。
【答案】环己醇 加成反应 羰基、酯基 ![]()
![]()


【解析】
结合C到D的反应及C的分子式可知C为![]() ,结合F的分子式及G的结构可知F为:
,结合F的分子式及G的结构可知F为:![]() ,据此解答。
,据此解答。
(1)( ![]() )为环己醇,G中的碳碳双键和H2发生加成反应生成I,即反应⑦为加成反应,故答案为:环己醇;加成反应;
)为环己醇,G中的碳碳双键和H2发生加成反应生成I,即反应⑦为加成反应,故答案为:环己醇;加成反应;
(2)E含有羰基和酯基两种官能团,C为己二酸,与乙二醇按酸脱羟基醇脱氢方式缩聚成H,则H为![]() ,故答案为:羰基、酯基;
,故答案为:羰基、酯基;![]() ;
;
(3)由分析可知,F为![]() ,故答案为:
,故答案为:![]() ;
;
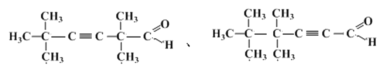
(4)结合反应⑧可知:![]() (甲基环丙基酮)被CF3COOOH(三氟过氧乙酸)氧化主要生成
(甲基环丙基酮)被CF3COOOH(三氟过氧乙酸)氧化主要生成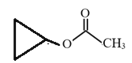 ,故答案为:
,故答案为: ;
;
(5)G有3个不饱和度,则R也有3个不饱和度,R能发生银镜反应,则必有1个-CHO,核磁共振氢谱为三组峰,峰面积之比为9:6∶1,则有3个-CH3与同一个C相连,有2个-CH3与同1个C相连,还剩2个不饱和度、2个C,则必有1个碳碳三键,综上所述,可能的结构为: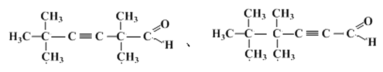 ,故答案为:
,故答案为: ;
;
(6)逆合成![]() 可由
可由 发生类似反应⑤得到,
发生类似反应⑤得到, 可由
可由![]() 发生类似反应④而来,
发生类似反应④而来,![]() 可由
可由 和乙醇发生酯化反应得到,综上所述,流程为:
和乙醇发生酯化反应得到,综上所述,流程为: ,故答案为:
,故答案为: 。
。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
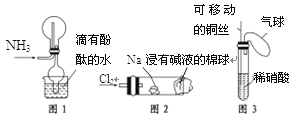
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
【答案】C
【解析】
分析每种装置中出现的相应特点,再判断这样的装置特点能否达到处理污染气体,减少污染的效果。
①图1所示装置在实验中用带有酚酞的水吸收逸出的氨气,防止氨气对空气的污染,符合“绿色化学”,故①符合题意;
②图2所示装置用沾有碱液的棉球吸收多余的氯气,能有效防止氯气对空气的污染,符合“绿色化学”,故②符合题意;
③氨气与氯化氢气体直接散发到空气中,对空气造成污染,不符合防止污染的理念,不符合“绿色化学”,故③不符合题意;
④图3所示装置中,铜丝可以活动,能有效地控制反应的发生与停止,用气球收集反应产生的污染性气体,待反应后处理,也防止了对空气的污染,符合“绿色化学”,故④符合题意;
故符合“绿色化学”的为①②④。
故选C。
【点睛】
“绿色化学”是指在源头上消除污染,从而减少污染源的方法,与“绿色化学”相结合的往往是原子利用率,一般来说,如果所有的反应物原子都能进入指定的生成物的话,原子的利用率为100%。
【题型】单选题
【结束】
17
【题目】为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
A.AB.BC.CD.D








