题目内容
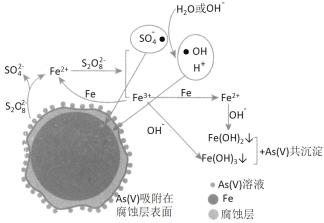
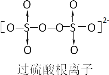
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(过硫酸根离子如图所示)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
A.室温下,中间产物 Fe(OH)3 溶于水所得饱和溶液中 c(Fe3+)为2.7×10-18 mol·L-1
B.若 56g Fe 参加反应,共有 NA 个 S2O82- 被还原
C.1mol 过硫酸钠(Na2S2O8)含 2NA 个过氧键
D.pH 越小,越有利于去除废水中的正五价砷
【答案】A
【解析】
A.已知Ksp[Fe(OH)3]=2.7×10-39,此溶液碱性极弱,溶液的pH接近7,即c(OH-)=10-7mol/L,代入方程即可解得:c(Fe3+)=2.7×10-18molL-1,故A正确;
B.56g Fe为1mol,根据图示,一个S2O82-和一个Fe反应生成两个SO42-和一个Fe2+,该过程转移2个电子,但是Fe2+还要与S2O82-反应变成Fe3+和自由基(SO4-●),因此1mol铁参加反应要消耗1.5molS2O82-,共有1.5NA个S2O82-被还原,故B错误;
C.根据Na2S2O8的结构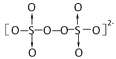 ,1mol过硫酸钠(Na2S2O8)含1mol过氧键,即含有NA个过氧键,故C错误;
,1mol过硫酸钠(Na2S2O8)含1mol过氧键,即含有NA个过氧键,故C错误;
D.根据图示,最后是将铁离子和亚铁离子转变为沉淀,与正五价砷共沉淀析出,则溶液的碱性越强,越有利于沉淀析出,即pH越大,越有利于去除废水中的正五价砷,故D错误;
故选A。

练习册系列答案
相关题目