题目内容
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:_________。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________(写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为________,H2O2的电子式为________。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②______;③用38℃~60℃热水洗涤; ④低于60℃干燥,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_______g·L1(杂质不参与反应,NaClO2中的氯元素被还原为Cl)。
【答案】Cl6e+6OH=ClO3-+3H2O 稀硫酸 2OH+2ClO2+H2O2=2ClO2-+2H2O+O2 ![]() 趁热过滤
趁热过滤 ![]()
【解析】
由流程可知,电解饱和食盐水得到氯酸钠溶液,向氯酸钠溶液中通入二氧化硫和空气,氯酸钠被还原为二氧化氯并被吹入吸收塔中,在碱性条件下,二氧化氯被双氧水还原生成亚氯酸钠。
(1)无隔膜电解槽中阳极上氯离子被氧化为氯酸根,电极反应式为Cl6e+6OH=ClO3-+3H2O。
(2)生成ClO2的反应中需用酸进行酸化,由于二氧化硫是较强的还原剂,故不能用强氧化性的酸(如硝酸,可以被还原为氮的氧化物),由于氯酸钠有强氧化性,也不能用还原性酸(如盐酸,可以被氧化为氯气),故为了防止气体中引入其他杂质,最宜选用的酸为稀硫酸。
(3)在碱性条件下,二氧化氯被双氧水还原生成亚氯酸钠,双氧水被氧化为氧气,故ClO2吸收塔中发生反应的离子方程式为2OH+2ClO2+H2O2=2ClO2-+2H2O+O2,H2O2是共价化合物,其电子式为![]() 。
。
(4)NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。因此,从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥,得到成品。
(5)由ClO2- +4I- +4H+=Cl- +2I2+2H2O、2I2 + 2Na2S2O3=2NaI + Na2S4O6可知,NaClO2~2I2 ~2Na2S2O3,则n(NaClO2)=0.5 n(Na2S2O3)= 0.5 V2 10-3L0.1000 mol·L1=5 V2 10-5 mol,则NaClO2的浓度为![]()
![]() g·L1。
g·L1。

 名校课堂系列答案
名校课堂系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
【题目】下列实验装置不能达到实验目的的是
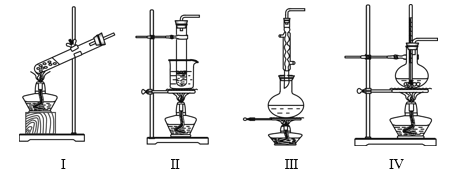
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D