题目内容
2.下列物质的水溶液经加热浓缩、蒸干灼烧后仍能得到原物质的是( )| A. | AlCl3 | B. | Ca(HCO3)2 | C. | NaAlO2 | D. | Na2SO3 |
分析 A.根据AlCl3的水解平衡移动生成氢氧化铝和氯化氢,氯化氢挥发得到水解产物蒸干灼烧得到氧化铝分析;
B.碳酸氢盐受热分解成碳酸钙;
C.根据强碱NaOH没有挥发性分析;
D.根据亚硫酸盐的还原性分析.
解答 解:A.的氯化铝在水中加热发生水解,产物氯化氢挥发,导致平衡右移直至水解完全,生成氢氧化铝,而氢氧化铝作为不溶性碱灼烧分解,生成氧化铝,故A错误;
B.碳酸氢盐受热分解成对应的碳酸盐,即碳酸钙,故B错误;
C.偏铝酸钠在溶液中以四羟基合铝酸钠(NaAl(OH)4 ),蒸干灼烧失水变成偏铝酸钠(NaAlO2),所以NaAlO2溶液蒸干灼烧仍能得到原物质,故C正确;
D.亚硫酸盐在空气中加热会被氧气氧化为硫酸盐,故D错误;
故选C.
点评 本题考查盐类水解的应用,是高考的热点之一,如在配制易水解的盐溶液时,如氯化铁溶液为了抑制水解可加入少量的盐酸,以防止溶液浑浊,题目较简单.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
10.NA表示阿伏伽德罗常数的值,下列关于0.2mol•L-1 K2SO4溶液的说法正确的是( )
| A. | 1000mL溶液中所含K+、SO42-总数为0.3NA | |
| B. | 500mL溶液中有0.1NA个K+ | |
| C. | 1L溶液中K+的浓度为0.4mol•L-1 | |
| D. | 1L溶液中SO4 2-的浓度是0.4mol•L-1 |
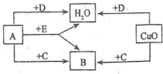 A、B、C、D、E是初中化学中常见的五种无色气体,其中有两种是单质,另三种是化合物,它们之间有如图所示的转化关系(图中未注明反应条件):
A、B、C、D、E是初中化学中常见的五种无色气体,其中有两种是单质,另三种是化合物,它们之间有如图所示的转化关系(图中未注明反应条件):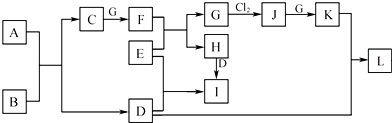
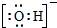 .
.