题目内容
17.化学反应与能量有比不可分的关系,回答下列问题.Ⅰ:已知31g白磷变为31g红磷释放能量.试回答:
(1)上述变化属于化学(填“物理”或“化学”)变化.
(2)31g白磷具有的能量>(“>”或“<”)31g红磷具有的能量,常温常压下,更稳定.
(3)31g白磷完全燃烧释放的能量> (“>”或“<”)31g红磷完全燃烧释放的能量.
Ⅱ:A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的稀硫酸
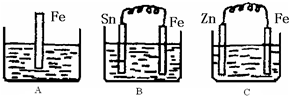
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
AFe+2H+=Fe2++H2↑;BFe-2e-=Fe2+;C2H++2e-=H2↑.
(2)一段时间后,B中Sn极附近溶液的酸性增强 (填“增强”、“减弱”、“不变”).
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度=mol•L-1.此时,三个烧杯中液体质量由大到小的顺序为:C>B>A(填写序号).
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是BAC (填写序号).
分析 Ⅰ:(1)根据白磷和红磷是不同的物质;
(2)根据白磷变为红磷释放能量;根据物质能量的高低与其稳定性的关系;
(3)根据化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量不同,生成物的能量相同,放出的能量也不同,
Ⅱ:(1)A、该反应是铁与硫酸反应的离子方程式;
B、根据原电池自发进行的氧化还原反应写出负极的电极反应;
C、根据原电池自发进行的氧化还原反应写出正极的电极反应;
(2)根据B中Sn极是正极,氢离子放电;
(3)根据氢气的体积计算硫酸的物质的量,根据溶液的体积计算物质的量浓度;根据溶液质量的变化等于进入和出去的物质的质量之差来判断;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
解答 解:Ⅰ:(1)因白磷和红磷是不同的物质,白磷变为红磷是化学变化,
故答案为:化学;
(2)因白磷变为红磷释放能量,所以白磷具有的能量大于红磷具有的能量,物质的能量越低,稳定性越好,
故答案为:>;
(3)因化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量大,生成物的能量相同,放出的能量也大,
故答案为:>,
Ⅱ:(1)A中是金属铁和硫酸能发生置换反应,原理方程式为:Fe+2H+=Fe2++H2↑;B中Sn、Fe、硫酸构成的原电池,金属铁较活泼,做负极,电极反应为:Fe-2e-=Fe2+,C中Zn、Fe、硫酸构成的原电池,金属锌较活泼,做负极,金属铁作正极,该极发生的电极反应为:2H++2e-=H2↑,
故答案为:Fe+2H+=Fe2++H2↑;Fe-2e-=Fe2+;2H++2e-=H2↑;
(2)B中Sn(锡)极发生的电极反应为:2H++2e-=H2↑,所以氢离子浓度减小,酸性减弱,pH增大,故答案为:增大;
(3)A中是金属铁和硫酸能发生置换反应,进入的是铁,出去的是氢气,质量增重是54,B中Sn、Fe、硫酸构成的原电池,进入的是铁,出去的是氢气,质量增重是54,C中Zn、Fe、硫酸构成的原电池,进入的是锌,出去的是氢气,质量增重是63,原来三个溶液的质量相等,而溶液质量的变化等于进入和出去的物质的质量之差,BC构成原电池反应速率大于A,但C中锌活动性大于Fe,所以C中生成氢气的反应速率最大,相同时间内三个容器中溶解金属质量大小顺序是C>B>A,所以三个烧杯中液体质量由大到小的顺序为:C>B>A,
故答案为:C>B>A;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,腐蚀速率最小,故答案为:BAC.
点评 本题主要考查了原电池的概念和工作原理知识、化学平衡的变化图象,题目难度不大,可以根据所学知识进行回答,本题要注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用

 阅读快车系列答案
阅读快车系列答案| A. | 8个中子的碳原子:12C | B. | HClO的结构式:H-Cl-O | ||
| C. | 镁离子的结构示意图: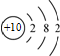 | D. | 乙酸的分子式:C2H4O2 |
| A. | NaHSO4晶体中阳离子和阴离子 | B. | Na2O2晶体中阴离子和阳离子 | ||
| C. | Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
| A. | 一定是化合物 | B. | 可能是单质,可能是化合物 | ||
| C. | 一定是单质 | D. | 一定是不同的单质 |
| A. | AlCl3 | B. | Ca(HCO3)2 | C. | NaAlO2 | D. | Na2SO3 |
| A. | 自行车的钢圈镀铬 | B. | 室外的铁制水管外面刷油漆 | ||
| C. | 电线外面包上一层塑料 | D. | 地下钢管连接铜块防腐 |
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba 2+ Mg2+ HCO3- | ||
| C. | NO3- K+Mg2+ Cl- | D. | NO3- Na+ K+ Cl- |
| A. | 若该溶液为Ba(OH)2,则充分反应后金属有剩余 | |
| B. | 若该溶液为H2SO4,则充分反应后金属有剩余 | |
| C. | 若该溶液分别为H2SO4、NaOH,则两者产生的氢气的物质的量相等 | |
| D. | 若该溶液为碳酸,则产生氢气后金属有剩余 |
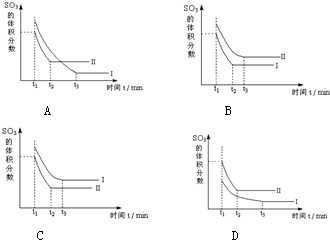
 500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同),充分反应,二者均达到平衡后:
500℃时,在催化剂存在条件下,分别将2mol SO2和1mol O2置于恒压容器I和恒容容器II中(两容器起始容积相同),充分反应,二者均达到平衡后: