题目内容
【题目】Ⅰ.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
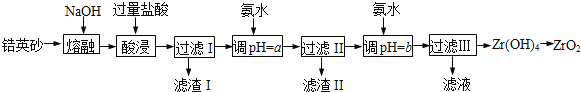
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为___________________________________________,滤渣I的化学式为___________________
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是____________________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为:________________________________________
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:____________________________
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:___SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。__________
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途
【答案】ZrSiO4 + 4NaOH![]() Na2SiO3 + Na2ZrO3 + 2H2O H2SiO3(或H4SiO4) 5.2~6.2 ZrO2+ + 2NH3·H2O + H2O=== Zr(OH)4↓+ 2NH4+ 2NH4+ + CaCO3
Na2SiO3 + Na2ZrO3 + 2H2O H2SiO3(或H4SiO4) 5.2~6.2 ZrO2+ + 2NH3·H2O + H2O=== Zr(OH)4↓+ 2NH4+ 2NH4+ + CaCO3![]() Ca2+ + 2NH3↑+ CO2↑+ H2O 取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净 3 6 2 1 6 28 g/mol AC
Ca2+ + 2NH3↑+ CO2↑+ H2O 取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净 3 6 2 1 6 28 g/mol AC
【解析】
锆英砂(主要成分为ZrSiO4,也可表示为ZrO2SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,ZrSiO4转化为Na2SiO3和Na2ZrO3,加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,滤液中含有ZrO2+、Fe3+、Al3+,加氨水调节pH为5.2~6.2,使Fe3+、Al3+转化为氢氧化物沉淀,过滤,滤液中主要含有ZrO2+,再加氨水调节pH使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
Ⅰ.(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,其反应的方程式为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣为H2SiO3,答案为:ZrSiO4+4NaOH
Na2SiO3+Na2ZrO3+2H2O;加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,过滤,滤渣为H2SiO3,答案为:ZrSiO4+4NaOH![]() Na2SiO3+Na2ZrO3+2H2O;H2SiO3(或H4SiO4);
Na2SiO3+Na2ZrO3+2H2O;H2SiO3(或H4SiO4);
(2)需用氨水调pH=a,使Fe3+、Al3+转化为氢氧化物沉淀,而ZrO2+不能沉淀,根据表中数据可知:pH在5.2~6.2时Fe3+、Al3+完全沉淀,而ZrO2+不沉淀;加氨水至pH=b时,ZrO2+与NH3H2O反应生成Zr(OH)4沉淀,其反应的离子方程式为:ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+;故答案为:5.2~6.2;ZrO2++2NH3H2O+H2O=Zr(OH)4↓+2NH4+;
(3)过滤Ⅲ所得滤液中主要含有铵根离子,溶液显酸性,加入CaCO3粉末并加热得到氨气和二氧化碳,其反应的离子方程式为:2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O;答案为:2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O;
(4)沉淀上附着的杂质为氯离子,用稀硝酸和硝酸银来检验洗液中是否含有氯离子即可,其操作为:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净;答案为:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净;
Ⅱ.(1)根据方程式可知,碳元素的化合价从0价升高到+2价,而氮元素的化合价从0价降低到-3价,所以根据电子的得失守恒可知,配平后的化学计量数依次是3;6;2;1;6;
(2)氮气是过量的,所以混合气是氮气和CO的混合气。但由于二者的相对分子质量都是28,所以混合气的平均摩尔质量是28g/mol;
(3)氮化硅不是电的良导体,选项B不正确;氮化硅的发展有广阔的发展前景,选项D不正确,选项AC是正确的,答案为AC;

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】下表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是__________(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=_________时,这类们机物开始出现同分异构休。
(3)B与乙醇反应的化学方程式为_____________,反应类型为_______________。
(4)以A为原料可直接生产一种高分子化合物P,则P的结构简式为_______________。
【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是_______________(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是_______________(填物质化学式),呈两性的氢氧化物是_____________(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,/span>M中含有的化学键类型有________________________;
(4)用电子式表示元素③与⑧形成化合物的过程_________________________________。
(5)写出含有32个电子的元素⑥的氢化物的分子式:_____________________________。
(6)写出工业冶炼⑤的化学方程式:____________________________________
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步:____________________________ ; 第三步Cl2+2Br-=2Cl-+Br2