题目内容
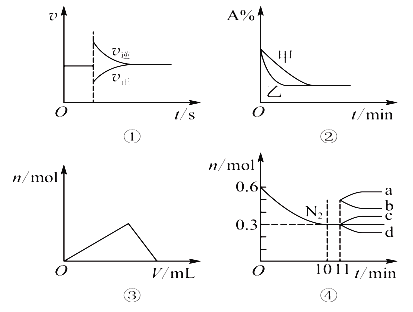
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。

(1)从反应开始到10 s,用Z表示的反应速率为______________,X的物质的量浓度减少了______________,Y的转化率为____________。
(2)该反应的化学方程式为__________________________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是________。

A.t1时刻,减小了Z的浓度 B.t1时刻,降低了体系温度
C.t1时刻,增大了容器体积 D.t1时刻,使用了催化剂
【答案】0.079 mol·L-1·s-1 ; ;0.395 mol·L-179%X(g)+Y(g) ![]() 2Z(g)D
2Z(g)D
【解析】
(1)反应开始到10s,用Z表示的反应速率为:v=![]() =1.58/2×10=0.079 mol·L-1·s-1 ;反应开始到10s,X的物质的量浓度减少的量为:c=(1.2-0.41)/2=0.395 mol·L-1 ;反应开始到10s时,Y的转化率为(1-0.21)/1×100%=79%;综上所述,本题答案是:0.079 mol·L-1·s-1 ;0.395 mol·L-1 ; 79%。
=1.58/2×10=0.079 mol·L-1·s-1 ;反应开始到10s,X的物质的量浓度减少的量为:c=(1.2-0.41)/2=0.395 mol·L-1 ;反应开始到10s时,Y的转化率为(1-0.21)/1×100%=79%;综上所述,本题答案是:0.079 mol·L-1·s-1 ;0.395 mol·L-1 ; 79%。
(2)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学反应中各物质的物质的量变化量与化学计量数之比呈正比,则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为X(g)+Y(g) ![]() 2Z(g);综上所述,本题答案是:X(g)+Y(g)
2Z(g);综上所述,本题答案是:X(g)+Y(g) ![]() 2Z(g)。
2Z(g)。
(3)由图象可以知道正逆反应速率增大,平衡没移动;
A.t1时刻,增大了X的浓度,平衡正移,不符合题意,故A错误;
B.t1时刻,降低了体系温度,平衡移动,不符合题意,故B错误;
C.t1时刻,增大了容器体积,相当于减小压强,速率均减小,,因为反应前后计量数相等,平衡不移动,不符合题意,故C错误;
D.t1时刻,使用了催化剂,速率增大,且增大程度一样,平衡不移动,符合题意,故D正确;
综上所述,本题选D。

【题目】Ⅰ.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
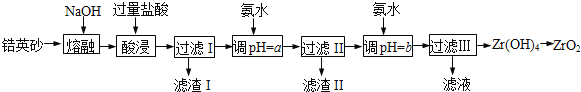
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为___________________________________________,滤渣I的化学式为___________________
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是____________________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为:________________________________________
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:____________________________
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:___SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。__________
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30 mol氮气,反应生成了5 mol一氧化碳,则此时混合气体的平均摩尔质量是______________。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是__________(填序号)
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备
B.在电子工业上制成耐高温的电的良导体
C.研发氮化硅的全陶发动机替代同类型金属发动机
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途