题目内容
【题目】(1)偏铝酸钠的水溶液呈___(填“酸”“中”或“碱”)性,原因是(用离子方程式表示):________________;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(离子方程式表示):__________________。
(3)用离子方程式表示泡沫灭火器灭火原理:__________________。
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):____________。
(5)碳酸氢钠溶液中离子浓度由大到小的顺序是:__________________。
【答案】 碱 AlO2-+ 2H2O =Al(OH)3 + OH- 抑制 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3+ + 3HCO3- == Al(OH)3↓+3CO2↑ CO32- +H2O =HCO3- + OH- [Na+]>[HCO3-]>[OH-]>[CO32-]>[H+]
Al(OH)3(胶体)+3H+ Al3+ + 3HCO3- == Al(OH)3↓+3CO2↑ CO32- +H2O =HCO3- + OH- [Na+]>[HCO3-]>[OH-]>[CO32-]>[H+]
【解析】(1)偏铝酸钠的水溶液呈碱性,原因是偏铝酸钠在水中发生了水解,离子方程式为:AlO2- + 2H2O![]() Al(OH)3 + OH-;实验室在配制AgNO3溶液时,溶液中的银离子水解显酸性,Ag++H2O
Al(OH)3 + OH-;实验室在配制AgNO3溶液时,溶液中的银离子水解显酸性,Ag++H2O![]() AgOH+H+,为抑制银离子的水解通常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
AgOH+H+,为抑制银离子的水解通常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
(2)明矾溶于水,铝离子水解形成氢氧化铝胶体能吸附水中的悬浮颗粒并沉降下来达到净水的目的,离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(3)泡沫灭火器原理是NaHCO3与Al2(SO4)3发生双水解反应,离子方程式为:Al3+ + 3HCO3- == Al(OH)3↓+3CO2↑;
(4)纯碱可代替洗涤剂洗涤餐具是因为碳酸钠水解显碱性,使油脂在碱性溶液中水解生成溶于水的物质而洗去,离子方程式为:CO32- +H2O ![]() HCO3- + OH-;
HCO3- + OH-;
(3)在碳酸氢钠溶液中,离子间存在着这样的关系HCO3-+H2O![]() H2CO3+OH-,HCO3-
H2CO3+OH-,HCO3-![]() H++CO32-,H2O
H++CO32-,H2O![]() H++OH-;由于HCO3-水解大于电离,说明碳酸氢钠溶液显碱性,且c(OH-) > c(CO32-),由于少部分水解和电离,则c(Na+)>c(HCO3-)>c(OH-)> c(CO32-),又由于 c(HCO3-) 产生的c(H+)与c(CO32-)数目相等,而水H2O电离也产生c(H+)。因此 c (H+) > c(CO32-),碳酸氢钠溶液中,离子浓度由大到小的顺序是:c(Na+)>c(HCO3-)>c(OH-)> c(H+) > c(CO32-)。
H++OH-;由于HCO3-水解大于电离,说明碳酸氢钠溶液显碱性,且c(OH-) > c(CO32-),由于少部分水解和电离,则c(Na+)>c(HCO3-)>c(OH-)> c(CO32-),又由于 c(HCO3-) 产生的c(H+)与c(CO32-)数目相等,而水H2O电离也产生c(H+)。因此 c (H+) > c(CO32-),碳酸氢钠溶液中,离子浓度由大到小的顺序是:c(Na+)>c(HCO3-)>c(OH-)> c(H+) > c(CO32-)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】海水中含有丰富的镁资源。某同学设计从模拟海水中制备MgO的实验方案:
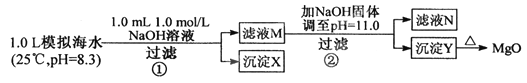
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
【注】溶液中某种离子的浓度小于1.0![]() 10-5mol
10-5mol![]() L-,可认为该离子不存在。
L-,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:
Ksp(CaCO3)=4.96![]() 10-9 Ksp(MgCO3)=2.1
10-9 Ksp(MgCO3)=2.1![]() 10-5
10-5
Ksp(Ca(OH)2)=4.68![]() 10-6 Ksp(Mg(OH)2)=5.61
10-6 Ksp(Mg(OH)2)=5.61![]() 10-12
10-12
下列说法正确的是
A. 沉淀物x为CaCO3
B. 滤液M中存在Mg2+ ,不存在Ca2+
C. 滤液N中存在Mg2+ , Ca2+
D. 步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2混合物