题目内容
【题目】生活中为了延长鲜花的寿命,通常会在花瓶中加入鲜花保鲜剂。下表是0.5 L某种鲜花保鲜剂中含有的成分及含量,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 25.00 | 342 |
硫酸钾(K2SO4) | 0.25 | 174 |
高锰酸钾(KMnO4) | 0.25 | 158 |
阿司匹林(C9H8O4) | 0.17 | 180 |
硝酸银(AgNO3) | 0.02 | 170 |
(1)鲜花保鲜剂的下列成分中,属于电解质的是________(填字母)。
a.蔗糖 b.硫酸钾
c.高锰酸钾 d.硝酸银
(2)欲配制480 mL该鲜花保鲜剂,现已提供下列仪器:
①胶头滴管、②量筒、③烧杯、④药匙、⑤电子天平,如要完成实验,缺少的玻璃仪器还有________(写仪器名称)。
(3)写出该鲜花保鲜剂中K+的物质的量浓度的计算式:________(不必化简)。
(4)将m g蔗糖完全燃烧后的产物通过足量的Na2O2固体,充分反应后,固体增加的质量________(填“>”“=”或“<”)m g。
【答案】bcd 玻璃棒、500 mL容量瓶 ![]() mol/L>
mol/L>
【解析】
(1)蔗糖是在水溶液和熔融状态下均不导电的化合物,属于非电解质,故a错。硫酸钾、高锰酸钾、硝酸银均是在水溶液和熔融状态下都能导电的化合物,属于电解质,故b、c、d正确。
(2)配制480 mL一定浓度的溶液时,用到的仪器有电子天平、烧杯、玻璃棒、胶头滴管、500 mL容量瓶等。
(3)K2SO4的物质的量为![]() mol,KMnO4的物质的量为
mol,KMnO4的物质的量为![]() mol,所以K+的物质的量浓度为
mol,所以K+的物质的量浓度为![]() mol/L。
mol/L。
(4)蔗糖完全燃烧生成CO2和水,然后分别和过氧化钠反应,即2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2↑。在这两个反应中,对Na2O2固体而言,Na2O2增重的质量实际是H2O中H2的质量和CO2中CO的质量,即其结果可看作Na2O2+H2=2NaOH,Na2O2+CO=Na2CO3。而蔗糖的分子式可表示为(CO)11H22C,则固体增加的质量大于蔗糖的质量。

【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
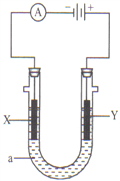
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。