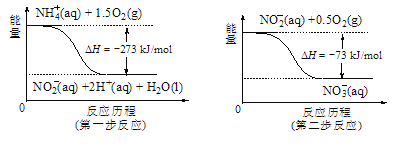
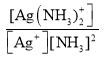题目内容
【题目】25℃时,向1L0.01 molL-1H2B溶液中滴加盐酸或NaOH溶液,溶液中 c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+) 的对数值(lgc)与pH的关系如图所示(温度保持不变),下列说法错误的是
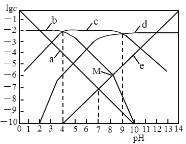
A.曲线c表示lgc(HB-)与pH的关系
B.随pH增加,c(H2B)c(OH-)增大
C.0.01 molL-1Na2B溶液,Kh1(B2-)的数量级为10-9
D.M点溶液中n(Na+)+n(H+)―n(B2-)=0.01mol
【答案】BC
【解析】
pH=-lgc(H+),所以a曲线代表c(H+),e曲线代表c(OH-);H2B可以NaOH发生反应H2B+NaOH=NaHB+H2O,NaHB+NaOH=Na2H+H2O,所以随溶液pH增大,c(H2B)逐渐减小,c(HB-)先增多后减小,c(B2-)逐渐增大,所以b代表c(H2B),c代表c(HB-),d代表c(B2-)。
A.根据分析可知曲线c表示lgc(HB-)与pH的关系,故A正确;
B.HB-的水解平衡常数的表达式为Kh=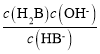 ,所以c(H2B)c(OH-)=Kh·c(HB-),而随pH增加,c(HB-)先增大后减小,水解平衡常数不变,所以c(H2B)c(OH-)先增大后减小,故B错误;
,所以c(H2B)c(OH-)=Kh·c(HB-),而随pH增加,c(HB-)先增大后减小,水解平衡常数不变,所以c(H2B)c(OH-)先增大后减小,故B错误;
C.Kh1(B2-)=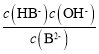 ,据图可知当c(B2-)= c(HB-)时溶液的pH=9,所以此时溶液中c(OH-)=10-5mol/L,则Kh1(B2-)=10-5mol/L,故C错误;
,据图可知当c(B2-)= c(HB-)时溶液的pH=9,所以此时溶液中c(OH-)=10-5mol/L,则Kh1(B2-)=10-5mol/L,故C错误;
D.M点溶液中存在电荷守恒2c(B2-)+c(HB-)+c(OH-)= c(Na+)+ c(H+),因为在同一溶液中,所以2n(B2-)+n(HB-)+n(OH-)=n(Na+)+n(H+),存在物料守恒n(B2-)+n(HB-)+n(H2B)=0.01mol,据图可知该点n(OH-)=n(H2B),所以n(B2-)+n(HB-)+n(OH-)=0.01mol,根据物料守恒可知n(HB-)+n(OH-)=n(Na+)+n(H+)-2n(B2-),带入可得n(Na+)+n(H+)―n(B2-)=0.01mol,故D正确;
故答案为BC。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案