题目内容
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
(1)NW3的电子式为___,HWO的结构式为__,Z在元素周期表中的位置是__,XO2分子中X原子采用杂化方式___。
(2)①X、Y、Z、W原子半径由大到小依次是___(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是__(填化学式)。
(3)X、Y、Z、W中第一电离能最小的是___,电负性最大的是___(填元素符号)。
【答案】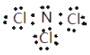 H-O-Cl 第三周期第ⅣA族 sp Al>Si>Cl>C HClO4>H2CO3>H2SiO3 Al Cl
H-O-Cl 第三周期第ⅣA族 sp Al>Si>Cl>C HClO4>H2CO3>H2SiO3 Al Cl
【解析】
X、Y、Z、W是短周期元素,原子序数依次递增,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Y应为Al;Z原子的最外层电子数是次外层电子数的一半,且Z的原子序数大于Al,所以Z为Si元素,X与Z同主族,则X为C元素; Y、Z、W原子的最外层电子数之和为14,W的最外层电子数为14-3-4=7,W为Cl,以此来解答。
(1)NW3为NCl3,为共价化合物,N原子与每个Cl原子共用一对电子,且N原子还有一对孤电子对,所以NCl3的电子式为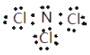 ;HClO的结构式为H—O—Cl;Z为Si元素,位于第三周期第ⅣA族;XO2为CO2,分子为直线形,C原子为sp杂化;
;HClO的结构式为H—O—Cl;Z为Si元素,位于第三周期第ⅣA族;XO2为CO2,分子为直线形,C原子为sp杂化;
(2)①Al、Si、Cl均位于第三周期,同周期主族元素的原子半径自左至右依次减小,C元素位于第二周期,原子半径最小,所以原子半径Al>Si>Cl>C;
②非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性Cl>C>Si,所以酸性:HClO4>H2CO3>H2SiO3;
(3)同周期主族元素自左至右第一电离能呈增大趋势,同主族元素自上而下第一电离能减小,所以第一电离能最小的元素是Al;非金属性越强电负性越大,四种元素中非金属性最强的是Cl元素,所以电负性最大的是Cl元素。

 阅读快车系列答案
阅读快车系列答案




