题目内容
【题目】丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示:

回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为___,本实验中最容易产生的副产物的结构简式为___。
(2)仪器b的作用为___。
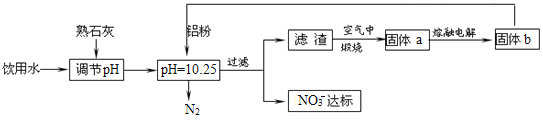
(3)混合液用5%Na2CO3溶液洗涤的目的是___。
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是___。
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,___,弃去前馏分,收集80.5℃的馏分。
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为___。
【答案】CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O CH3OCH3 冷凝回流 除去混合液中的丙烯酸、浓硫酸和甲醇(降低丙烯酸甲酯的溶解度) 烧杯、玻璃棒、量筒 通冷凝水、加热 54.0%
CH2=CH-COOCH3+H2O CH3OCH3 冷凝回流 除去混合液中的丙烯酸、浓硫酸和甲醇(降低丙烯酸甲酯的溶解度) 烧杯、玻璃棒、量筒 通冷凝水、加热 54.0%
【解析】
利用该实验装置制备并提纯丙烯酸甲酯,装置a中将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸混合用搅拌棒搅拌,水浴加热发生反应制取丙烯酸甲酯,发生反应为CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O,制得的粗品丙烯酸甲酯用5%Na2CO3溶液洗去混合液中丙烯酸、甲醇和浓硫酸至中性,经干燥过滤,利用水浴加热蒸馏分离出丙烯酸甲酯,蒸馏操作时,冷凝水的方向与蒸汽的流动方向相反,温度计测定蒸汽的温度,水银球在蒸馏烧瓶的支管口处,将制得的丙烯酸甲酯利用中和滴定的原理进行含量的测定并计算含量,据此分析解答。
CH2=CH-COOCH3+H2O,制得的粗品丙烯酸甲酯用5%Na2CO3溶液洗去混合液中丙烯酸、甲醇和浓硫酸至中性,经干燥过滤,利用水浴加热蒸馏分离出丙烯酸甲酯,蒸馏操作时,冷凝水的方向与蒸汽的流动方向相反,温度计测定蒸汽的温度,水银球在蒸馏烧瓶的支管口处,将制得的丙烯酸甲酯利用中和滴定的原理进行含量的测定并计算含量,据此分析解答。
I(1)根据分析,三颈烧瓶中进行的可逆反应化学方程式为CH2=CH-COOH+CH3OH![]() CH2=CH-COOCH3+H2O,结合乙醇的消去反应,在一定温度下,乙醇在浓硫酸作用下发生分子间脱水生成乙醚,本实验中使用的反应物中有甲醇,具有乙醇相似的化学性质,在浓硫酸作用下,达到一定温度,甲醇也会发生分子间脱水生成甲醚,则最容易产生的副产物的结构简式为CH3OCH3;
CH2=CH-COOCH3+H2O,结合乙醇的消去反应,在一定温度下,乙醇在浓硫酸作用下发生分子间脱水生成乙醚,本实验中使用的反应物中有甲醇,具有乙醇相似的化学性质,在浓硫酸作用下,达到一定温度,甲醇也会发生分子间脱水生成甲醚,则最容易产生的副产物的结构简式为CH3OCH3;
(2)制取丙烯酸甲酯过程中,反应物丙烯酸、甲醇都易挥发,导致原子利用率较低,制备产率也较低,仪器b的作用为冷凝回流,提高反应物的利用率,从而提高产量;
(3)混合液中有丙烯酸甲酯、丙烯酸、甲醇、浓硫酸,浓硫酸、丙烯酸能与Na2CO3溶液反应,甲醇能溶于碳酸钠溶液中,所以用5%Na2CO3溶液洗涤的目的是除去混合液中的丙烯酸、浓硫酸和甲醇(降低丙烯酸甲酯的溶解度);
(4)配制100g 5% Na2CO3溶液通常用的玻璃仪器是烧杯、玻璃棒、量筒;
(5)将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,通冷凝水、加热,弃去前馏分,收集80.5℃的馏分;
II(6)中和过量的KOH,滴到终点时共消耗盐酸20.00mL,即0.5×0.02mol=0.01mol,所以用于水解的KOH的物质的量为0.025mol0.01mol=0.015mol,所以用于生成CH2=CHCOOCH3的CH2=CHCOOH的质量为:0.05mol×72g/mol=1.08g,参加实验的样品为原样品的![]() ,则丙烯酸的转化率为:
,则丙烯酸的转化率为: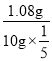 ×100%=54.0%。
×100%=54.0%。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案