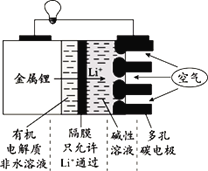
题目内容
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJmol-1
2NO(g)+O2(g) 2NO2(g)△H=-113.0 kJ·mol-1
则 SO2 气体与 NO2 气体反应生成 SO3 气体和 NO 气体的热化学方程式为 _______________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质: SO2(g)+2CO(g)![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为______;当时间为第4s时,v(SO2)正_____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入 1 mol CO2 和 3.0 mol H2,在不同催化 剂作用下,相同时间内 CO2 的转化率随温度变化如图所示:
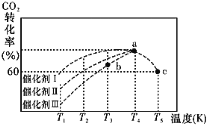
①催化剂效果最佳的是催化剂 _______(填“I”“II”或“III”)。
②此反应中a点的转化率比b点高的原因是__________________ 。 已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数 Kp=_____(保 留两位有效数字)(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
【答案】SO2(g)+NO2(g)![]() NO(g)+SO3(g) △H=-41.8kJ·mol-1 CO2 < Ⅰ a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低 8.3×10-4(kPa)-2
NO(g)+SO3(g) △H=-41.8kJ·mol-1 CO2 < Ⅰ a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低 8.3×10-4(kPa)-2
【解析】
根据盖斯定律得到热化学方程式;根据原子守恒思想得出X的化学式;当时间为第4s时,已经达到平衡,则速率比等于计量系数比,该反应是放热反应,温度越高,平衡逆向移动,建立三段式,先计算平衡后的压强,再根据压强平衡常数计算。
(1)①第一个方程式减去第二个方程式,再除以2得到SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为SO2(g)+NO2(g)![]() SO3(g) +NO(g) △H=-41.8 kJ·mol-1,故答案为:SO2(g)+NO2(g)
SO3(g) +NO(g) △H=-41.8 kJ·mol-1,故答案为:SO2(g)+NO2(g)![]() SO3(g) +NO(g) △H=-41.8 kJ·mol-1;
SO3(g) +NO(g) △H=-41.8 kJ·mol-1;
②Y为S,根据原子守恒思想得出X的化学式为CO2;当时间为第4 s时,已经达到平衡,则速率比等于计量系数比,故2v(SO2)正=v(X)逆,则v(SO2)正<v(X)逆,故答案为:CO2;<;
(2)①T3温度以前,相同温度下,催化剂Ⅰ的催化效率更高;故答案为:I;
②该反应是放热反应,温度越高,平衡逆向移动,因此a点的转化率比b点高的原因是a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低,故答案为:a点温度比b点高,a比b应先到达化学平衡状态,故a点已达平衡,平衡转化率高,而b点未到达平衡,转化率低;
已知容器内的起始压强为100 kPa,c点时CO2的转化率为60%,可列三段式:
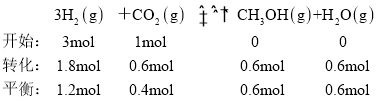
利用压强之比等于物质的量之比,![]() ,反应后的压强为
,反应后的压强为![]() ,
,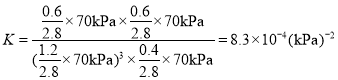 ;故答案为:a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;
;故答案为:a点达到平衡,c点温度升高,反应是放热反应,平衡逆向,转化率减小;![]() 。
。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案