题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:K+、Cr2O72-、Cl-、H+
B.![]() =1×1012的溶液中:K+、Na+、CO32-、NO3-
=1×1012的溶液中:K+、Na+、CO32-、NO3-
C.c(SO32-)=0.1mol·L-1的溶液中:Na+、Cl-、H+、Ca2+
D.使pH试纸变红的溶液中:NH4+、Al3+、SO42-、Cl-
【答案】D
【解析】
A、Cr2O72-呈橙色,其在酸性溶液中具有强氧化性,可以氧化Cl-,故该选项不符合题意,A错误;
B、![]() =1×1012的溶液呈酸性,则CO32-不能大量存在,故该选项不符合题意,B错误;
=1×1012的溶液呈酸性,则CO32-不能大量存在,故该选项不符合题意,B错误;
C、SO32-和H+反应生成HSO3-、SO2,也会和Ca2+反应形成CaSO3沉淀,故H+、Ca2+不能大量存在,即该选项不符合题意,C错误;
D、使pH试纸变红的溶液呈酸性,该组离子可以大量共存,即该选项符合题意,D正确;
故选D。

【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常要采用不同方法处理,以实现节能减排、废物利用等。
(1)下列为二氧化硫和氮的氧化物转化的部分环节:
①已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6 kJmol-1
2NO(g)+O2(g) 2NO2(g)△H=-113.0 kJ·mol-1
则 SO2 气体与 NO2 气体反应生成 SO3 气体和 NO 气体的热化学方程式为 _______________。
②一定条件下,工业上可通过下列反应实现燃煤烟气中液态硫的回收,其中Y是单质: SO2(g)+2CO(g)![]() 2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
2X(g)+Y(l)。为了测定在某种催化剂作用下的反应速率,某化学兴趣小组在某温度下、固定容器中用超灵敏气体传感器测得不同时间的 SO2 和 CO 浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
X的化学式为______;当时间为第4s时,v(SO2)正_____(填“>”“=”或“<”)v(X)逆。
(2)有科学家经过研究发现,在210~290℃、催化剂条件下用H2可将CO2转化生成甲醇蒸气和水蒸气。一定条件下,往2 L恒容密闭容器中充入 1 mol CO2 和 3.0 mol H2,在不同催化 剂作用下,相同时间内 CO2 的转化率随温度变化如图所示:
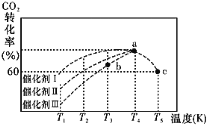
①催化剂效果最佳的是催化剂 _______(填“I”“II”或“III”)。
②此反应中a点的转化率比b点高的原因是__________________ 。 已知容器内的起始压强为100 kPa,则图中c点对应温度下反应的平衡常数 Kp=_____(保 留两位有效数字)(Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。