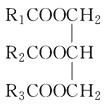��Ŀ����
����Ŀ�����⻯��NaBH4��BԪ�صĻ��ϼ�Ϊ+3�ۣ�ȼ�ϵ�أ�DBFC�������ھ��б������ߡ������������Ⱦ��ȼ�����ڴ����������ŵ㣬����Ϊ��һ�ֺ��з�չDZ����ȼ�ϵ�أ��乤��ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��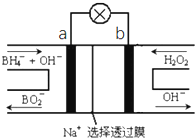
A.�ŵ�ʱ��ÿת��2mol���ӣ���������Ҫ����9.5gNaBH4
B.�缫a����MnO2 �� MnO2�����缫�������д�����
C.��طŵ�ʱNa+��b��������a����
D.��صĸ�����ӦΪBH4��+2H2O��8e���TBO2��+8H+
���𰸡�A
��������A����������������Ӧ����BO2�� �� �缫��ӦʽΪBH4��+8OH����8e��=BO2��+6H2O��ÿת��2mol���ӣ���������Ҫ����0.25mol��9.5gNaBH4 �� ��A��ȷ��
B���缫b����MnO2 �� Ϊ������H2O2������ԭ��Ӧ���õ����ӱ���ԭ����OH�� �� MnO2�����缫�������д����ã���B����
C��ԭ��ع���ʱ���������������ƶ������������ƶ�����Na+��a��������b��������C����
D����������������Ӧ����BO2�� �� �缫��ӦʽΪBH4��+8OH����8e��=BO2��+6H2O����D����
��ѡA��

��ϰ��ϵ�д�
 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д� ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
�����Ŀ