题目内容
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Br-、Cl-、CrO42- B. Cl-、Br-、CrO42-
C. CrO42-、Br-、Cl- D. Br-、CrO42-、Cl-
【答案】A
【解析】析出沉淀时,AgCl溶液中c(Ag+)=Ksp(AgCl)/c(Cl)=1.56×1010/0.01mol/L=1.56×10-8mol/L;AgBr溶液中c(Ag+)=Ksp(AgBr)/c(Br)=7.7×1013/0.01mol/L=7.7×10-11mol/L;Ag2CrO4溶液中c(Ag+)= 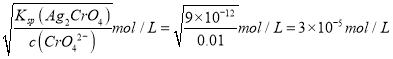 ,c(Ag+)越小,则越先生成沉淀,所以三种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,答案选A。
,c(Ag+)越小,则越先生成沉淀,所以三种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-,答案选A。

练习册系列答案
相关题目