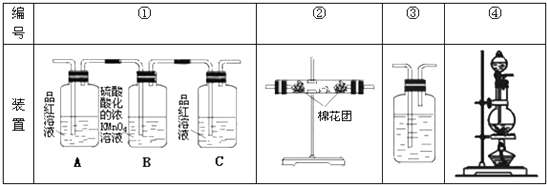
��Ŀ����
����Ŀ��ij����С������ͼװ�ý���ʵ�飬�Իش��������⣮ 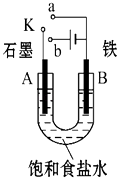
��1������ʼʱ����K��a���ӣ���B���ĵ缫��ӦʽΪ ��
��2������ʼʱ����K��b���ӣ���B���ĵ缫��ӦʽΪ �� �ܷ�Ӧ�����ӷ���ʽΪ ��
��3��������K��b���ӣ�����˵����ȷ���ǣ�����ţ� ��
����Һ��Na+��A���ƶ�
�ڴ�A�����ݳ���������ʹʪ���KI������ֽ����
�۷�Ӧһ��ʱ������������ɻָ������ǰ����ʵ�Ũ��
������״����B������2.24L���壬����Һ��ת��0.2mol����
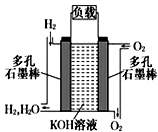
��4�����ģ�ҵ�����ӽ���Ĥ�����ռ�ķ��������Ƶõ�����������������������Һ���Ϊ����ȼ�ϵ�أ����������ĵ缫��ӦʽΪ ��
���𰸡�
��1��Fe��2e��=Fe2+
��2��2H++2e��=H2����2Cl��+2H2O ![]() Cl2��+H2��+2OH��
Cl2��+H2��+2OH��
��3���ڢ�
��4��O2+4 ![]() +2H2O�T4OH��
+2H2O�T4OH��
���������⣺��1����ʼʱ����K��a���ӣ���ԭ��أ���Ϊ����������������Ӧ��ʧȥ���������������ӣ��缫����ʽΪFe��2e��=Fe2+ �� A���������õ��ӱ���ԭ���缫����ʽΪO2+2H2O+4e��=4OH�� �� ���Դ��ǣ�Fe��2e��=Fe2+����2������K��b���ӣ�װ��Ϊ���أ���Ϊ������������ԭ��Ӧ�������ӵõ����������������缫����ʽΪ2H++2e��=H2�����ܵĵ缫��Ӧ�ǵ�ⱥ��ʳ��ˮ���缫��Ӧ����ʽΪ��2Cl��+2H2O ![]() Cl2��+H2��+2OH�� �� ���Դ��ǣ�2H++2e��=H2����2Cl��+2H2O
Cl2��+H2��+2OH�� �� ���Դ��ǣ�2H++2e��=H2����2Cl��+2H2O ![]() Cl2��+H2��+2OH������3���ٵ��ʱ�������������ƶ����ʢٴ���A������������ʹʪ��KI������ֽ�������ʢ���ȷ����������������������������������ͨ�������Ȼ���ɻָ���ԭŨ�ȣ��ʢ۴�������״����B������2.24L��������2H++2e��=H2����֪ת��0.2mol���ӣ��ʢ���ȷ�����Դ��ǣ��ڢܣ���4������������ԭ��Ӧ�������ŵ��������������ӣ��缫��ӦʽΪ��O2+4e��+2H2O�T4OH�� �� ���Դ��ǣ�O2+4e��+2H2O�T4OH�� ��
Cl2��+H2��+2OH������3���ٵ��ʱ�������������ƶ����ʢٴ���A������������ʹʪ��KI������ֽ�������ʢ���ȷ����������������������������������ͨ�������Ȼ���ɻָ���ԭŨ�ȣ��ʢ۴�������״����B������2.24L��������2H++2e��=H2����֪ת��0.2mol���ӣ��ʢ���ȷ�����Դ��ǣ��ڢܣ���4������������ԭ��Ӧ�������ŵ��������������ӣ��缫��ӦʽΪ��O2+4e��+2H2O�T4OH�� �� ���Դ��ǣ�O2+4e��+2H2O�T4OH�� ��

 ��У����ϵ�д�
��У����ϵ�д�