题目内容
【题目】根据题意解答
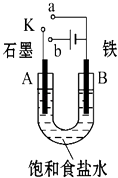
(1)用铜、银与硝酸银设计一个原电池,此电池的负极是 , 负极的电极反应式是 .
(2)如图为氢氧燃料碱性电池,电极材料为疏松多孔石墨棒. 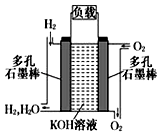
根据所学知识试回答下列问题:
①写出氢氧燃料电池工作时正极电极反应方程式: .
②如果该氢氧燃料电池每转移1mol电子,消耗标准状况下氧气的体积为 .
③阳离子向极移动(填写正或负),反应一段时间后整个溶液的碱性(填增强,减弱或者不变).
④若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 .
【答案】
(1)铜;Cu﹣2e﹣═Cu2+
(2)O2+2H2O+4e﹣=4OH﹣;5.6L;正;减弱;CH4+10OH﹣﹣8e=CO32﹣+7H2O
【解析】解:(1)铜、银与硝酸银设计的原电池,负极为铜,被氧化发生氧化反应,电极方程式为:Cu﹣2e﹣═Cu2+ , 所以答案是:铜;Cu﹣2e﹣═Cu2+;(2)①氢氧燃料电池中,电解质溶液为碱,则正极上氧气得电子和水生成氢氧根离子,则其电极反应式为:2H2O+O2+4e﹣═4OH﹣; 所以答案是:2H2O+O2+4e﹣═4OH﹣;②已知2H2O+O2+4e﹣═4OH﹣ , 则每转移1mol电子消耗的氧气为: ![]() ×1mol=0.25mol,所以V(O2)=nVm=0.25mol×22.4L/mol=5.6L;
×1mol=0.25mol,所以V(O2)=nVm=0.25mol×22.4L/mol=5.6L;
所以答案是:5.6L;③原电池中阳离子移向正极;燃料电池的总反应为2H2+O2=2H2O,反应后溶液体积增大,溶液的碱性减弱;
所以答案是:正;减弱;④燃料电池中,负极上燃料失电子发生氧化反应,碱性条件下,甲烷在负极生成碳酸根离子,其电极反应式为CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O,所以答案是:CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案