题目内容
【题目】根据题意填空
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物. 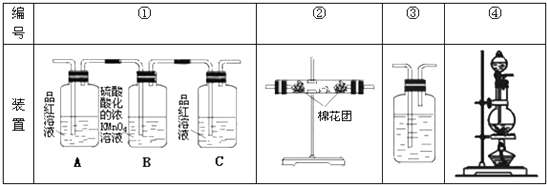
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):→→→
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 , B瓶溶液的作用是 , C瓶溶液的作用是 .
(4)装置②中所加固体药品是 , 可验证的产物是 , 确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 , 可验证的产物是 .
【答案】
(1)C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(2)④;②;①;③
(3)验证产物气流中是否有SO2;将SO2全部氧化吸收;确定产物中SO2已被B瓶溶液全部氧化
(4)无水硫酸铜;水蒸气;由于产物气流通过①、③会带出水蒸气,所以②必须在①、③之前
(5)澄清石灰水;CO2
【解析】解:(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,即C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O, 故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O, 故答案为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O;(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳,故答案为:④→②→①→③;(3)根据检验的顺序,在检验二氧化碳之前先检验二氧化硫,可以用品红来检验,除二氧化硫可以用高锰酸钾,二氧化硫是否被高锰酸钾吸收干净,也可以用品红来检验,
CO2↑+2SO2↑+2H2O;(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳,故答案为:④→②→①→③;(3)根据检验的顺序,在检验二氧化碳之前先检验二氧化硫,可以用品红来检验,除二氧化硫可以用高锰酸钾,二氧化硫是否被高锰酸钾吸收干净,也可以用品红来检验,
故答案为:验证产物气流中是否有SO2;将SO2全部氧化吸收;确定产物中SO2已被B瓶溶液全部氧化;(4)以用无水硫酸铜来检验水的产生,检验二氧化碳和二氧化硫时用到的溶液中均含有水,产物气流通过①、③会带出水蒸气,所以先检验水的存在,
故答案为:无水硫酸铜;水蒸气;由于产物气流通过①、③会带出水蒸气,所以②必须在①、③之前;(5)可以用澄清石灰水检验二氧化碳的存在,故答案为:澄清石灰水;CO2 .
(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水;(2)检验二氧化碳和二氧化硫时用到的溶液中均含有水,所以先检验水的存在,二氧化碳和二氧化硫均可以使澄清石灰水变浑浊,所以先检验二氧化硫,再除去,最后检验二氧化碳;(3)可以用品红来检验溶液是否褪色,并可以用品红来检验二氧化硫是否除尽;(4)可以用无水硫酸铜来检验水的产生,根据二氧化碳和二氧化硫的检验试剂来确定水的检验的位置;(5)可以用澄清石灰水检验二氧化碳的存在.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示: 
部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1molL﹣1的NaClO3溶液200ml,该反应离子方程式为 .
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是 .
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 . 如果维持电流强度为5A,电池工作五分钟,理论消耗锌g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 . 向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2 , 铁溶解变为Fe3+ , 加碱调节pH为时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全).继续加碱调节pH为时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1).若上述过程不加H2O2 , 其后果和原因是