题目内容
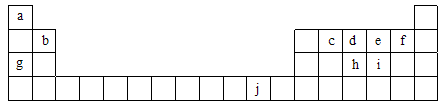
(12分)有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表:
请回答下列问题:
(1)A、B两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为 ,其中B原子采取 杂化。
(2)B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)。
(3)C的氢化物比F的氢化物的沸点__________(填“高”或“低”),C的氢化物比F的氢化物的稳定性__________(填“强”或“弱”)。
(4)A2D的VSEPR模型名称为__________;
写出与A2D分子互为等电子体的微粒__________(填一种)
(5)写出E3C2的电子式 ;
(6)G的基态原子核外电子排布式为 。
| 元素编号 | 相关信息 |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| C | 基态时, 2p 轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| F | 与E同周期,原子核外所有p轨道:有的全满有的半满 |
| G | 是第四周期元素中未成对电子数最多的元素 |
(1)A、B两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为 ,其中B原子采取 杂化。
(2)B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)。
(3)C的氢化物比F的氢化物的沸点__________(填“高”或“低”),C的氢化物比F的氢化物的稳定性__________(填“强”或“弱”)。
(4)A2D的VSEPR模型名称为__________;
写出与A2D分子互为等电子体的微粒__________(填一种)
(5)写出E3C2的电子式 ;
(6)G的基态原子核外电子排布式为 。
(1)5:1、 sp2 (2) O>N>C (3)高、强 (4)四面体、NH2-
(5) (6)1s22s22p63s23p63d54s1
(6)1s22s22p63s23p63d54s1
(5)
 (6)1s22s22p63s23p63d54s1
(6)1s22s22p63s23p63d54s1根据元素的相关信息可知,A是H。B是C。C是N。D是O。E的第四电离能比第二电离能大很多,说明E是第ⅡA,因此是Mg。F是P。第四周期元素中未成对电子数最多的元素是24号元素Cr。
(1)乙烯的产量常用作为衡量石油化工发展水平的标志,所以甲是CH2=CH2。由于单键全部是δ键,双键是由1个σ键和1个π键构成,所以乙烯分子中σ键和π键的个数比为5:1。乙烯是平面型结构,碳原子是sp2杂化。
(2)非金属性越强,电负性越大,所以B、C、D三种元素的电负性由大到小的顺序为O>N>C。
(3)氨气中含有羟基,所以沸点高于PH3的沸点。氮氮非金属性强于P的,所以氢化物的稳定性也强于P的氢化物。
(4)H2O的中心原子含有2对孤电子对数,所以水的VSEPR模型名称为四面体,但实际结构是V形。原子数和电子书都相等的分子是等电子体。所以和H2O互为等电子体的是NH2-。
(5)E3C2是Mg3N2.属于离子化合物,含有离子键,所以电子式为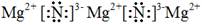
(6)根据构造原理可知,Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1。
(1)乙烯的产量常用作为衡量石油化工发展水平的标志,所以甲是CH2=CH2。由于单键全部是δ键,双键是由1个σ键和1个π键构成,所以乙烯分子中σ键和π键的个数比为5:1。乙烯是平面型结构,碳原子是sp2杂化。
(2)非金属性越强,电负性越大,所以B、C、D三种元素的电负性由大到小的顺序为O>N>C。
(3)氨气中含有羟基,所以沸点高于PH3的沸点。氮氮非金属性强于P的,所以氢化物的稳定性也强于P的氢化物。
(4)H2O的中心原子含有2对孤电子对数,所以水的VSEPR模型名称为四面体,但实际结构是V形。原子数和电子书都相等的分子是等电子体。所以和H2O互为等电子体的是NH2-。
(5)E3C2是Mg3N2.属于离子化合物,含有离子键,所以电子式为
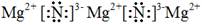
(6)根据构造原理可知,Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1。

练习册系列答案
相关题目
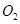 与
与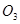
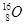 与
与