题目内容
5.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法正确的是( )| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X>R | |
| C. | Z的单质能与Y的某些化合物发生置换反应 | |
| D. | R的最高价氧化物对应水化物分子为HRO3或H3RO4 |
分析 R、X、Y、Z都是短周期元素,根据元素在周期表中的位置知,R是第二周期元素,X、Y、Z属于第三周期元素,X原子最外层电子数比次外层电子数少3,则其最外层电子数是5,则X是P元素,所以R是O、Y是S、Z是Cl元素,再结合元素化合物性质及元素周期律解答.
解答 解:R、X、Y、Z都是短周期元素,根据元素在周期表中的位置知,R是第二周期元素,X、Y、Z属于第三周期元素,X原子最外层电子数比次外层电子数少3,则其最外层电子数是5,则X是P元素,所以R是O、Y是S、Z是Cl元素,
A.元素的非金属性越强,其氢化物越稳定,R的非金属性大于X,则R的氢化物比X的氢化物稳定,故A错误;
B.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:X>Y>Z>R,故B错误;
C.氯气与硫化物发生反应:Cl2+H2S=S↓+2HCl,置换出硫单质,故C正确;
D.R为O元素,不存在最高价氧化物对应水化物,故D错误,
故选C.
点评 本题考查位置结构性质的相互关系及应用,根据元素在周期表中的位置及原子结构确定元素,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.三联苯 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.
 的一氯代物有( ) 种同分异构体.
的一氯代物有( ) 种同分异构体.| A. | 3 | B. | 4 | C. | 2 | D. | 5 |
13.下列关于化学键的叙述,正确的是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有金属元素的物质中均存在离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
10.已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 mol•L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
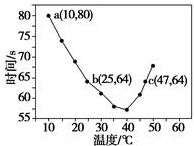

| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
17.若X+酸?盐+水,则X不可能属于( )
| A. | 氧化物 | B. | 单质 | C. | 碱 | D. | 电解质 |
14.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | |
| B. | 原子序数 d>c>b>a | |
| C. | 离子半径 C>D>B>A | |
| D. | 原子结构的最外层电子数目 A>B>D>C |
15.将13.2g可能混有下列物质的(NH4)2SO4样品,在加热的条件下,与过量的NaOH反应,可收集到4.3L NH3(标准状况),则样品中不可能含有的物质是( )
| A. | NH4HCO3、NH4NO3 | B. | (NH4)2CO3、NH4NO3 | C. | NH4HCO3、NH4Cl | D. | NH4Cl、(NH4)2CO3 |
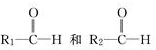 ;
;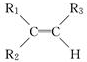 被氧化为
被氧化为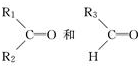 ,由此可判断分子式为C4H8的烯烃的氧化产物有( )
,由此可判断分子式为C4H8的烯烃的氧化产物有( ) W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题: