题目内容
【题目】下列有关实验操作,现象和解释或结论都正确的是
| 操作 | 现象 | 解释或结论 |
A | 向某溶液中通入Cl2,再加入CCl4、振荡,静置 | 溶液分层,上层呈紫色 | 说明溶液中含有I- |
B | 向Fe(NO3)2溶液加入盐酸酸化的KSCN溶液 | 溶液变成血红色 | Fe(NO3)2已经变质 |
C | FeCl3溶液加入过量的KI溶液,再加入KSCN溶液 | 溶液变成血红色 | Fe3+与I-反应为可逆反应 |
D | 向玻璃片上分别滴几滴氢氟酸和NaOH溶液 | 玻璃片慢慢被腐蚀 | SiO2是两性氧化物能与酸、碱反应 |
A.AB.BC.CD.D
【答案】C
【解析】
A选项,生成碘,因四氯化碳密度比水大,显色层在下层,上层应为无色,故A错误;
B选项,在酸性条件下,硝酸根离子可将二价铁离子氧化为三价铁离子,无法验证Fe(NO3)2是否变质,故B错误;
C选项,FeCl3溶液加入过量的KI溶液,再加入KSCN溶液,溶液变成血红色,说明仍然含有![]() ,证明Fe3+与I-反应为可逆反应,故C正确;
,证明Fe3+与I-反应为可逆反应,故C正确;
D选项,SiO2是酸性氧化物,故D错误。
综上所述,答案为C。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。查阅资料:
平衡Ⅰ:![]()
平衡Ⅱ:![]()
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/mgL-1 | 72 | ≤0.5 |
NH4+/mgL-1 | 2632 | ≤15 |
下列说法错误的是( )
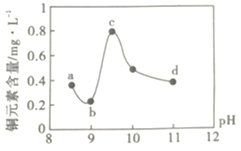
A.a~b段发生的反应为:![]()
B.b~c段:随pH升高,Cu(OH)2的量增加,导致平衡Ⅰ正向移动,铜元素含量上升
C.c~d段:随pH升高,c(OH-)增加,平衡Ⅰ逆向移动,铜元素含量下降
D.d点以后,随c(OH-)增加,铜元素含量可能上升