题目内容
【题目】已知C3H8的燃烧热(△H)为-2219.9kJ/mol,且C3H8和H2O的汽化热分别为18.8KJ/mol、44.0kJ/mol。(汽化热是指在一定温度下,1mol物质由液态变成气态的过程中所吸收的热量。)
(1)试计算8.8g以液化石油气存在的C3H8在氧气中完全燃烧生成水蒸气时放出的热量为____________。
(2)在体积可变的密闭容器中投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强変化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强変化如图1所示。
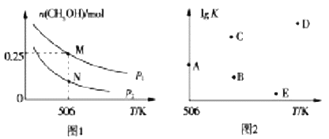
①M点时,H2的转化率为_________;压强:p1________p2(填“>”“<”或“=’’)
②反应速率:N点v正(CO)_________M点v逆(CO) (填“>”“<”或“=’’)
③若压强为p1、在1L恒容密闭容器中进行上述反应(应始投料不变,在不同温度下上述反应的平衡常数的对数(lgK)如图2所示。则温度为506K时,平衡常数K=________(保留三位小数),B、C、D、E四点中能正确表示该反应的lgK与T的关系的点为________。
④某温度下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)![]() CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,该温度下,现往容器中继续通入3molCO,此时v(正)________v(逆)(选填“>”“<”或“=’’),用数据说明理由___________________。
CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,该温度下,现往容器中继续通入3molCO,此时v(正)________v(逆)(选填“>”“<”或“=’’),用数据说明理由___________________。
(3)以二甲醚(CH3OCH3)为燃料、氧气为氧化剂、KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性材料)。
①若KOH溶液足量,则负极的电极反应式为____________。
②若电解质溶液中KOH的物质的量为0.2mol,当有0.1mol二甲醚参加反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________________。
【答案】 405.02kJ 25% > < 0.148L2·mol-2 BE = Qc=K=9,平衡不移动 CH3OCH3+16OH--12e-=2CO32-+11H2O c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
【解析】(1)根据C3H8的燃烧热可得反应的热化学方程式为C3H8(l)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=-2219.9kJ/mol,且C3H8与H2O的汽化热分别为18.8kJ/mol和44kJ/mol,根据反应的方程式可知气体C3H8发生反应时,生成气态H2O时放出的热量为-2219.9kJ/mol+18.8kJ/mol+4×44kJ/mol=-2025.1kJ/mol,8.8g液化石油气中含C3H8的物质的量为0.2mol,则释放的热量为0.2mol×2025.1kJ/mol=405.02kJ;正确答案:405.02kJ。
3CO2(g)+4H2O(l) ΔH=-2219.9kJ/mol,且C3H8与H2O的汽化热分别为18.8kJ/mol和44kJ/mol,根据反应的方程式可知气体C3H8发生反应时,生成气态H2O时放出的热量为-2219.9kJ/mol+18.8kJ/mol+4×44kJ/mol=-2025.1kJ/mol,8.8g液化石油气中含C3H8的物质的量为0.2mol,则释放的热量为0.2mol×2025.1kJ/mol=405.02kJ;正确答案:405.02kJ。
(2) ①M点时,生成的CH3OH为0.25 mol,消耗H2的物质的量为0.25mol×2=0.50 mol,则H2的转化率α(H2)=0.5/2×100%=25%;此反应的正反应是气体分子数减小的反应,增大压强,平衡向正反应方向移动。由题图1知,在相同温度下p2到p1,CH3OH的物质的量增大,说明平衡向正反应方向移动,即p1>p2;正确答案:25%;>。
②M、N点对应的温度相同,但M点对应的压强较大,反应速率较大;N点v正(CO)<M点v逆(CO);正确答案:<。
③506 K时, CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol·L-1) 1 2 0
转化(mol·L-1) 0.25 0.50 0.25
平衡(mol·L-1) 0.75 1.50 0.25
K=![]() =
=![]() L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意;正确答案:0.148L2·mol-2 ;BE。
L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意;正确答案:0.148L2·mol-2 ;BE。
④达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,则三种物质的浓度为c(CO)=c(H2)=c(CH3OH)=1/3mol/L, K=1/3/(1/3)2×1/3=9;该温度下,现往容器中继续通入3molCO,根据体积比和物质的量成正比可知,6mol混合气体的体积为6L,所以三种物质的浓度分别为c(CO)=4/6 mol/L=2/3 mol/L, c(H2)=1/6 mol/L, c(CH3OH)= 1/6 mol/L,该反应的浓度商Qc=1/6/(1/6)2×2/3=9=K,平衡不移动,此时v(正)=v(逆);正确答案:= ;Qc=K=9,平衡不移动。
(3)①二甲醚(CH3OCH3)为燃料电池,二甲醚做负极,失电子发生氧化反应,生成二氧化碳,在KOH溶液足量的情况下,最终生成碳酸钠溶液,则负极的电极反应式为: CH3OCH3+16OH--12e-=2CO32-+11H2O;正确答案:CH3OCH3+16OH--12e-=2CO32-+11H2O。
②根据碳原子守恒规律,当有0.1mol二甲醚参加反应时,生成CO2为0.2mol,0.2molCO2与0.2mol的KOH恰好完全反应生成碳酸氢钾溶液,水解过程大于电离过程,溶液显碱性,因此溶液中各种离子的物质的量浓度由大到小的顺序是:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);正确答案:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。

 名校课堂系列答案
名校课堂系列答案