题目内容
【题目】对SO3的说法正确的是( )
A. 结构与NH3相似 B. 结构与SO2相似
C. 结构与BF3相似 D. 结构与P4相似
【答案】C
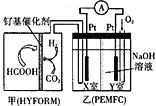
【解析】三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+![]() ×(6-3×2)=3,且不含孤电子对,所以为平面三角形结构。A.氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+
×(6-3×2)=3,且不含孤电子对,所以为平面三角形结构。A.氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+![]() ×(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形,选项A错误;B.SO2分子中,S原子形成2个δ键,孤对电子数为
×(5-3×1)=4,且含有一个孤电子对,所以其空间构型为三角锥形,选项A错误;B.SO2分子中,S原子形成2个δ键,孤对电子数为![]() ×(6-2×2)=1,价层电子对个数=σ键个数+孤电子对个数=1+2=3,且含有一个孤电子对,所以立体构型为V型,选项B错误;C.BF3分子中心原子硼原子价层电子对个数=
×(6-2×2)=1,价层电子对个数=σ键个数+孤电子对个数=1+2=3,且含有一个孤电子对,所以立体构型为V型,选项B错误;C.BF3分子中心原子硼原子价层电子对个数=![]() =3,无孤电子对,分子空间构型为平面三角形,三氧化硫分子为平面三角形结构,选项C正确;D.白磷(P4)属于单质,属于分子晶体,立体构型为正四面体型,三氧化硫分子为平面三角形结构,选项D错误;答案选C。
=3,无孤电子对,分子空间构型为平面三角形,三氧化硫分子为平面三角形结构,选项C正确;D.白磷(P4)属于单质,属于分子晶体,立体构型为正四面体型,三氧化硫分子为平面三角形结构,选项D错误;答案选C。

【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
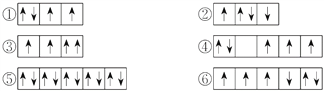
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】试题分析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
解析:(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;(2)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;(3)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。
【题型】综合题
【结束】
18
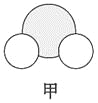
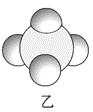
【题目】四种短周期元素A、B、C、D的性质或结构信息如下。
信息①:原子半径大小:A>B>C>D
信息②:四种元素之间形成的某三种分子的比例模型及部分性质:
|
|
|
是地球上最常见的物质之一,常温为液态,是包括人类在内所有生命生存的重要资源,也是生物体最重要的组成部分 | 无色,无味且易燃,是21世纪的主要能源 | 弱酸,有强氧化性,可以用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)甲、乙、丙中含有的共同元素是 (填名称)。
(2)B元素在周期表中的位置为 。
(3)上述元素的原子M层有一个未成对p电子的是 (填元素符号)。
(4)丙的电子式为 ,丙与SO2水溶液可发生氧化还原反应,生成两种强酸,化学反应方程式为 。