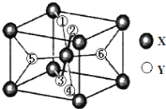
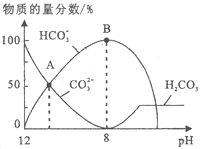
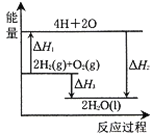
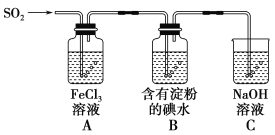
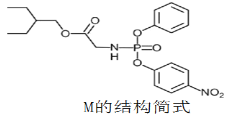
题目内容
【题目】工业上用铝土矿(主要成分为![]() ,还含有杂质
,还含有杂质![]() 和
和![]() )提取氧化铝并冶炼
)提取氧化铝并冶炼![]() 的操作过程如下:
的操作过程如下:
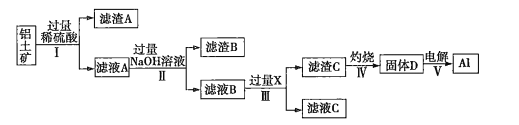
(1)滤渣A是______,滤渣B是__________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是____________。
(3)生成滤渣C的离子方程式为___________________________________________。
(4)取100 mL滤液B,加入200mL 1.0 ![]() 的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中
的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中![]() ________,
________,![]() _______
_______ ![]() 。
。
【答案】![]()
![]() (或氢氧化铁) 过滤
(或氢氧化铁) 过滤 ![]()
![]() 6.0
6.0
【解析】
铝土矿中加入过量稀硫酸,二氧化硅不与稀硫酸反应形成滤渣A,氧化铁、氧化铝与稀硫酸反应生成铝离子、铁离子,滤液A中有铝离子、铁离子;滤液A中加入过量的氢氧化钠溶液生成氢氧化铁沉淀和偏铝酸钠。根据固体D电解生成铝,推知D为氧化铝,C为氢氧化铝。偏铝酸钠与过量的X生成氢氧化铝,推知X为二氧化碳。
(1)铝土矿中的二氧化硅与稀硫酸不反应,则滤渣A是![]() (或二氧化硅);滤液A中含有铝离子、铁离子,加入过量的氢氧化钠,则滤渣B是
(或二氧化硅);滤液A中含有铝离子、铁离子,加入过量的氢氧化钠,则滤渣B是![]() (或氢氧化铁)。
(或氢氧化铁)。
(2)操作Ⅰ、Ⅱ、Ⅲ后分为滤渣和滤液,故名称均是过滤。
(3)由于二氧化碳是过量的,则生成滤渣C的离子方程式为![]() 。
。
(4)取100mL滤液B,加入200mL![]() 的盐酸时,沉淀量达到最大且质量为11.7g,即氢氧化铝是11.7g,其物质的量是
的盐酸时,沉淀量达到最大且质量为11.7g,即氢氧化铝是11.7g,其物质的量是![]() ,根据铝原子守恒可知,滤液B中
,根据铝原子守恒可知,滤液B中![]() 。根据方程式
。根据方程式![]() 可知
可知![]() 消耗氢氧化钠0.6 mol,又因为氢氧化钠还会与硫酸等反应,因此最终滤液B中
消耗氢氧化钠0.6 mol,又因为氢氧化钠还会与硫酸等反应,因此最终滤液B中![]() 的浓度大于
的浓度大于![]() 。
。

练习册系列答案
相关题目