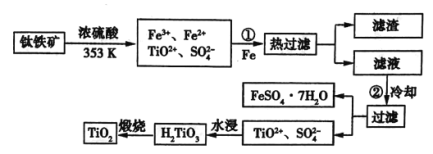
题目内容
【题目】面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
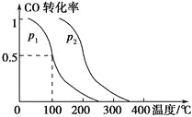
①p1 ________ p2(填“大于”、“小于”或“等于”);
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”),平衡常数_____(填“增大”、“减小”或“不变”)。
(3)已知在T℃时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,此时刻υ正 ______υ逆 (填“>”、“<”或“=”)。
【答案】CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1 小于 增大 不变 没有 >
【解析】
(1)根据已知热化学方程式和盖斯定律进行计算;
(2)①根据压强对平衡移动的影响进行判断,判断压强对平衡的影响时,须让温度相同;
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到的新平衡,相当于对原平衡增大压强,再根据压强对平衡移动的影响进行判断转化率的变化;温度不变,平衡常数不变;
(3)已知平衡常数,计算此刻的浓度商,进行比较,判断反应进行的方向。
(1)已知热化学方程式①CO(g)+2H2(g)CH3OH(g) ΔH1= -90 kJ·mol-1;②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2= -41 kJ·mol-1;根据盖斯定律,①-②可得由二氧化碳、氢气制备甲醇的热化学方程式为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1;
故答案为:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1;
(2)①对于反应CO(g)+2H2(g)CH3OH(g),当温度一定时,加压平衡正向移动,CO转化率增大,由图像可知,压强为p1时,CO转化率小,压强为p2时,CO转化率大,则p1 小于p2;
故答案为:小于;
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到的新平衡,相当于对原平衡增大压强,则CO的转化率增大;温度不变,平衡常数不变;
故答案为:增大;不变;
(3)已知在T℃时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,可列三段式计算此时浓度商,
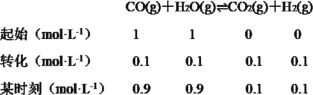
此时浓度商为:![]() ,则反应正向进行,没有达到平衡状态,υ正 >υ逆;
,则反应正向进行,没有达到平衡状态,υ正 >υ逆;
故答案为:没有;>。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案