题目内容
19.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 5.4g Al分别与含溶质0.2 mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA | |
| B. | 5.35g NH4Cl固体中含有的N-H键个数为0.4NA | |
| C. | 将含有1mol FeCl3的浓溶液全部制成胶体,含Fe(OH)3胶粒的数目为NA | |
| D. | 120g熔融的NaHSO4中含阳离子总数为2NA |
分析 A.根据n=$\frac{m}{M}$计算出铝的物质的量,然后分别判断氢氧化钠、盐酸的过量情况,根据不足量计算出生成氢气的物质的量;
B.根据n=$\frac{m}{M}$计算出氯化铵的物质的量,氯化铵中含有4个氮氢键;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.熔融硫酸氢钠中含有的阳离子只有钠离子.
解答 解:A.5.4g铝的物质的量为:$\frac{5.4g}{27g/mol}$=0.2mol,0.2molAl完全反应消耗0.2molNaOH,生成氢气为0.3mol;0.2molAl完全反应消耗HCl0.6mol,显然盐酸不足,0.2molHCl完全反应生成0.1mol氢气,二者生成氢气的量不同,故A错误;
B.5.35g氯化铵的物质的量为:$\frac{5.35g}{53.5g/mol}$=0.1mol,0.1mol氯化铵中含有0.4mol氮氢键,含有的N-H键个数为0.4NA,故B正确;
C.由于氢氧化铁胶体粒子为氢氧化铁的聚集体,则无法计算溶液中氢氧化铁胶粒的数目,故C错误;
D.120g硫酸氢钠的物质的量为:$\frac{120g}{120g/mol}$=1mol,1mol熔融硫酸氢钠中含有1mol钠离子和1mol硫酸氢根离子,含有阳离子总数为NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
9.下列离子方程式正确的是( )
| A. | AlCl3溶液中通入过量的氨水:Al3++4NH3•H2O=AlO2-+2H2O+4NH4+ | |
| B. | 向NH4HCO3 溶液中加过量NaOH 溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将Cu片加入稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:2S2O32-+2H+=SO42-+3S↓+H2O |
10.硫酸的产量是衡量一个国家化工水平的标志.2SO2(g)+O2(g)═2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.
下列判断中,正确的是( )
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.4 | 0.8 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲中反应的平衡常数大于乙 | B. | 平衡时,SO2的转化率:α1<80%<α2 | ||
| C. | 该温度下,乙中平衡常数值为400 | D. | 平衡时,丙中c(SO3)是甲中的2倍 |
14.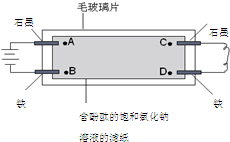 如图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液).有关说法正确的是( )
如图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液).有关说法正确的是( )
 如图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液).有关说法正确的是( )
如图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液).有关说法正确的是( )| A. | A点比B点先出现红色 | B. | B点比A点先出现红色 | ||
| C. | C点比A点先出现红色 | D. | D点比C点先出现红色 |
4.76.8mgCu与足量浓硝酸反应,铜作用完全后,如果NO3-减少2×10-3mol,则溶液中H+同时下降( )
| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
11.汽车排气管加装催化装置,可有效减少CO和NOx的排放.催化装置内发生的反应为:NOx+CO→N2+CO2,下列说法一定正确的是( )
| A. | 上述氧化物均为酸性氧化物 | |
| B. | 反应中既有极性键也有非极性键形成 | |
| C. | 当x=2时,转移的电子数为4×6.02×1023 | |
| D. | 该反应为置换反应 |
8.(多项选择题)下列有机物分子中的所有碳原子一定在同一平面上的是( )
| A. | 乙苯 | B. | 反-2-丁烯 | C. | 环己烷 | D. | 对二甲苯 |
9.用NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•Lˉ1的醋酸溶液中CH3COOH和CH3COOˉ的总数为NA | |
| B. | 1 molNa2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 39g苯中所含的碳碳双键为1.5 NA | |
| D. | 23g乙醇中所含的羟基数为0.5 NA |
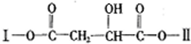 (其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化:
(其中I、II为未知部分的结构)为推测X的分子结构,进行如图的转化: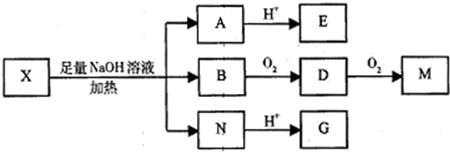
 ;
;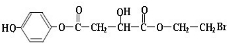 ;
;