题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标况下,11.2LCCl4中含有共价键数目为2NA
B. 1 mol Cl2 与足量的铁反应转移的电子数目是3NA
C. 2molSO2和1mol18O2充分反应,产物中含18O原子数为2NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
【答案】D
【解析】
A.标况下,CCl4为液态,不可利用气体摩尔体积计算,故A错误;
B. 1 mol Cl2 与足量的铁反应转移的电子数目是2NA,故B错误;
C.反应可逆不可进行到底,故C错误;
D. H218O和2H2O的共同点是相对分子质量均为20,每个分子中子数均为10,故18gH218O和2H2O的混合物中所含中子数为![]() NA=9NA,故D正确;
NA=9NA,故D正确;
答案:D

 名校课堂系列答案
名校课堂系列答案【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL﹣1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL﹣1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL﹣1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是___________________________________(用过渡态理论来解释);
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_______________________;
(3)实验①和②的目的是_____________________________________________________;实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是____________________________________;
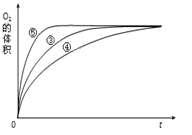
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析图能够得出的实验结论是_________________________________________。