题目内容
【题目】按要求完成下列问题:
(1)相对分子质量为72且沸点最低的烷烃的结构简式为________
(2)键线式![]() 表示的分子式为________;名称是___________________。
表示的分子式为________;名称是___________________。
(3)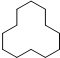 1 mol该烃完全燃烧需消耗氧气的物质的量为______mol。
1 mol该烃完全燃烧需消耗氧气的物质的量为______mol。
(4)松油醇(![]() )的官能团的名称为_________
)的官能团的名称为_________
(5)戊基有____种结构,请写出其中的核磁共振氢谱有二个吸收峰的结构简式_____。
(6)分子式为C4H4且含两种官能团的链状有机物的结构简式为____________
【答案】  C6H14 2-甲基戊烷 18 碳碳双键、羟基 8 —CH2C(CH3)3 HC
C6H14 2-甲基戊烷 18 碳碳双键、羟基 8 —CH2C(CH3)3 HC![]() C-CH=CH2
C-CH=CH2
【解析】(1)根据烷烃通式确定该烷烃中碳原子个数,烷烃的同分异构体中,支链越多,其沸点越低;(2)系统命名法原则:①长-----选含有官能团的最长碳链为主链;②多-----遇等长碳链时,支链最多为主链;③近-----离支链最近一端编号;④小-----支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近-----离支链最近一端编号”的原则;⑤简-----两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;(3)有机物质燃烧的耗氧量=碳原子数+![]() ;(4)根据官能团的概念确定官能团的名称;(5)根据烷烃基只存在碳链异构结合等效氢原子的判断方法知识来回答;(2)根据分子式C4H4,得知其不饱和度为3,因为该有机物含有两种官能团,故其结构中应含一
;(4)根据官能团的概念确定官能团的名称;(5)根据烷烃基只存在碳链异构结合等效氢原子的判断方法知识来回答;(2)根据分子式C4H4,得知其不饱和度为3,因为该有机物含有两种官能团,故其结构中应含一![]() 和一个
和一个 。
。
(1)设该烷烃中碳原子个数是n,通式为CnH2n+2,14n+2=72,n=5,所以该烷烃是戊烷,烷烃的同分异构体中,支链越多,其沸点越低,所以相对分子质量为72且沸点最低的烷烃的结构简式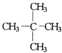 ;(2)
;(2)![]() 分子中含有6个碳原子,属于饱和烃,分子式为C6H14;根据系统命名法命名,该有机物的名称是2-甲基戊烷;(3)根据键线式,可以知道有机物中有12个碳原子,所以名称是环十二烷,有机物质燃烧的耗氧量=碳原子数+
分子中含有6个碳原子,属于饱和烃,分子式为C6H14;根据系统命名法命名,该有机物的名称是2-甲基戊烷;(3)根据键线式,可以知道有机物中有12个碳原子,所以名称是环十二烷,有机物质燃烧的耗氧量=碳原子数+![]() ,即为12+
,即为12+![]() =18,故1 mol该烃完全燃烧需消耗氧气的物质的量为18mol;(4)根据官能团的概念,该有机物中的官能团有:碳碳双键、羟基;(5)戊基存在碳链异构,共计有8种结构,即
=18,故1 mol该烃完全燃烧需消耗氧气的物质的量为18mol;(4)根据官能团的概念,该有机物中的官能团有:碳碳双键、羟基;(5)戊基存在碳链异构,共计有8种结构,即![]()
![]()
![]() ;其中的核磁共振氢谱有二个吸收峰,即含有两种等效氢原子的结构是-CH2C(CH3)3;(5)根据分子式C4H4,得知其不饱和度为3,因为该有机物含有两种官能团,故其结构中应含一
;其中的核磁共振氢谱有二个吸收峰,即含有两种等效氢原子的结构是-CH2C(CH3)3;(5)根据分子式C4H4,得知其不饱和度为3,因为该有机物含有两种官能团,故其结构中应含一![]() 和一个
和一个 。结构简式为HC
。结构简式为HC![]() C-CH=CH2。
C-CH=CH2。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:则表中a为
化学键 | H-H | Br- Br | H-Br |
断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
A. 200B. 230C. 260D. 404
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
【题目】如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。

溶液 | 加入的物质 | 字母代号 |
①饱和石灰水 | 通过量CO2 | ________ |
②AlCl3溶液 | 通过量NH3 | ________ |
③MgCl2、AlCl3混合溶液 | 逐滴加NaOH溶液至过量 | ________ |
④AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
⑤含少量HCl的AlCl3溶液 | 逐滴加NaOH溶液至过量 | ________ |
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______(答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________(写一种方法即可).