题目内容
【题目】反应2A(g)+B(g)![]() 3C(g)+D(g),△H=akJ/mol。反应过程中的能量变化如图所示。回答下列问题:
3C(g)+D(g),△H=akJ/mol。反应过程中的能量变化如图所示。回答下列问题:
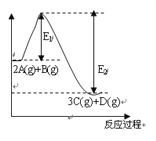
⑴a_____0 (填“<”“>”“=”)。
⑵该反应的熵变 △s_______0 (填“<”“>”“=”),在_________(填“高”、“低”、“任何”)温度能正向自发进行。
⑶若反应在恒容恒温条件下进行,且A、B的起始浓度分别为 5mol/L、2mol/L,10min后平衡时D的浓度为1mol/L,C物质的量为3mol,则容器的容积为_________L,B的转化率为________,A的反应速率为______________,化学平衡常数为___________。
【答案】 < > 任何 1 50% 0.2mol/(L·min) 3
【解析】(1)由能量变化图可知,反应物的总能量大于生成物,此反应为放热反应,即△H<0,则a<0;此可逆反应升高温度时,平衡逆向移动,平衡常数减小;(2)已知反应2A(g)+B(g)3C(g)+D(g),正方向是气体总量增大的方向,即△s>0;已知此反应的△H<0、△s>0,根据△G=△H-T△s可知,在任何温度下,△G均小于0,即均能自发进行;
(3) 2A(g)+B(g)3C(g)+D(g)
起始浓度(mol/L) 5 2 0 0
变化浓度(mol/L) 2 1 3 1
平衡浓度(mol/L) 3 1 3 1
则:容器的体积V=![]() =1L;B的转化率为:
=1L;B的转化率为:![]() ×100%=50%;A的平衡反应速率为:
×100%=50%;A的平衡反应速率为:![]() =0.2mol/(Lmin);此反应的平衡常数K=
=0.2mol/(Lmin);此反应的平衡常数K=![]() =
=![]() =3。
=3。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:则表中a为
化学键 | H-H | Br- Br | H-Br |
断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
A. 200B. 230C. 260D. 404